[考点]
溶液的酸碱度测定,碱的化学性质,燃烧与燃烧的条件,
[答案]
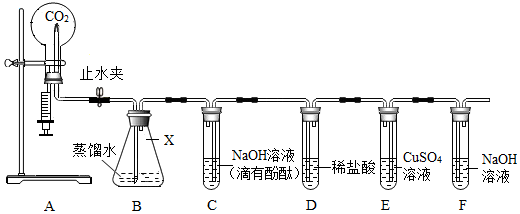
(1)锥形瓶。
(2)2NaOH+CO2═Na2CO3+H2O。
(3)产生蓝色沉淀。
(4)pH试纸。
(5)④。
[解析]
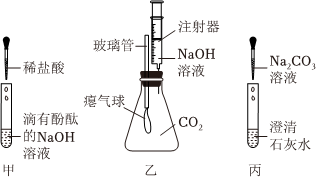
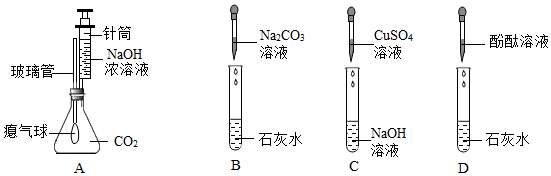
解:(1)图中仪器X的名称是锥形瓶。
故填:锥形瓶。
(2)注入NaOH溶液后,A中烧瓶内氢氧化钠和二氧化碳反应生成碳酸钠和水,发生反应的化学方程式是:2NaOH+CO2═Na2CO3+H2O。
故填:2NaOH+CO2═Na2CO3+H2O。
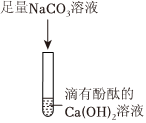
(3)“连锁反应”后,F中的氢氧化钠溶液进入E中,氢氧化钠和硫酸铜反应生成蓝色沉淀氢氧化铜和硫酸钠,E试管中的现象为产生蓝色沉淀。
故填:产生蓝色沉淀。
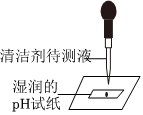
(4)小丽同学为测定反应后A烧瓶中溶液的酸碱度,她可以使用pH试纸。
故填:pH试纸。
(5)①盛澄清石灰水时,可以检验实验室制出的二氧化碳气体,该选项说法正确;
②盛烧碱溶液时,可以除去一氧化碳中的二氧化碳气体,该选项说法正确;
③盛浓硫酸时,可以除去氧气中的水蒸气,该选项说法正确;
④盛适量冷水并放入一小块白磷时,不能验证可燃物燃烧的条件,是因为温度没有达到白磷的着火点,该选项说法不正确。
故填:④。
[点评]
本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。