服务热线
搜题▪组卷
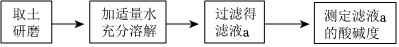
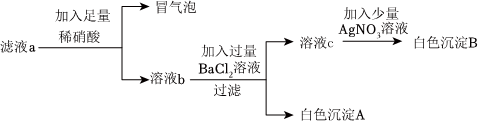
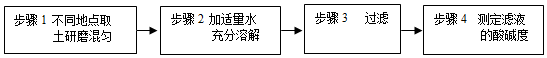
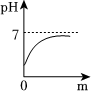
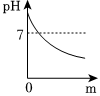
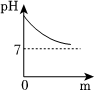
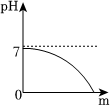
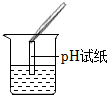
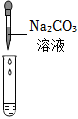
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |
|
|
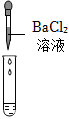
|
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 产生气泡 | |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
| 取C中反应后的溶液于试管中 | 步骤 | 现象 | 结论 |
| 向其中滴加 溶液(填化学式),微热 | 有刺激性气味产生 | 猜想Ⅲ成立 |
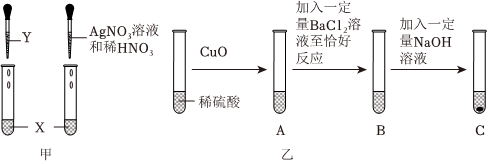
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 甲同学 | 取少量样品溶液于试管中,滴加 溶液 | 有气泡产生 | 猜想一不成立 |
| 乙同学 | ①先另取少量样品溶液于试管中,加入过量氯化钡溶液 | 猜想 成立 | |
| ②然后静置,向反应后的上层清液中,滴加2~3滴的无色酚酞溶液 | 上层清液变红 |
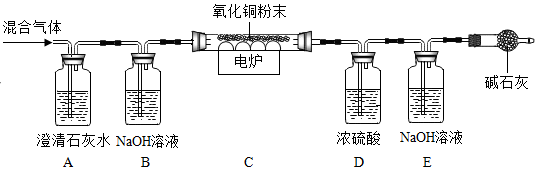
| 装置 | 实验现象/数据 | 实验结论 |
| A | 石灰水变浑浊 | 通过实验现象和数据,小组成员一致认为该气体样品中含有 。 |
| B | 无明显现象 | |
| C | 黑色粉末变成红色 | |
| D | 装置D增重3.6g | |
| E | 装置E增重4.4g |
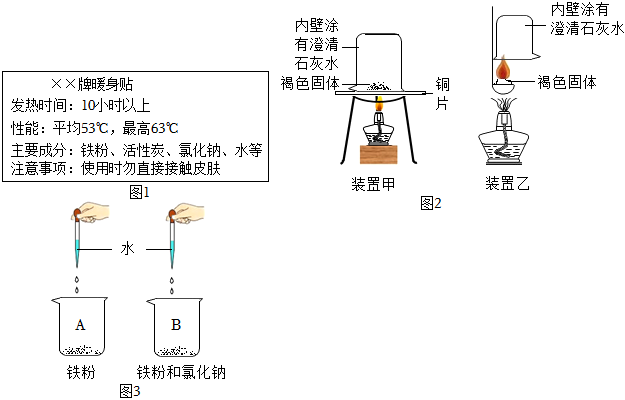
| 实验步骤 | 实验现象 | 实验结论 |
| Ⅰ.取褐色固体于烧杯中,加入足量稀盐酸,充分反应后过滤。 | 无气泡产生,滤液为黄色,滤渣为黑色。 | 猜想 成立。 |
| Ⅱ.取少量步骤Ⅰ得到的滤渣于装置甲中铜片上,充分加热。 | 滤渣燃烧,澄清石灰水变浑浊。 | 固体中含有 (填物质名称)。 |
| Ⅲ.取少量步骤Ⅰ得到的滤液于试管中,向试管中滴入AgNO3溶液。 | 固体中含有氯化钠。 |
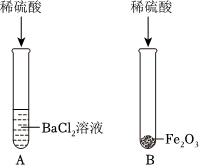
| 步骤 | 操作 | 现象 | 结论 |
| ① | 取少量白色滤渣于试管中,滴加足量稀盐酸 | 有气泡产生 | 溶液中无 (填离子符号) |
| ② | 取少量滤液于试管中,滴加稀硫酸 | 溶液中存在Ba2+ | |
| ③ | 取少量滤液于试管中,滴加氯化钡溶液 | 无明显现象 | 溶液中无 |
| ④ | 取少量滤液于试管中,滴加 溶液 | 溶液变红 | 溶液中存在OH﹣ |
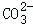

| 实验步骤 | 实验现象 | 实验结论 | |
| 方案一 | ①取少量溶液于试管中,滴加无色酚酞溶液 ②继续滴加稀盐酸 |
①溶液变红 ②产生气泡 |
①有OH﹣ ②有 |
| 方案二 | ①取少量溶液于试管中,滴加足量 溶液 ②继续滴加FeCl3溶液 |
①有白色沉淀生成 ② |
①有 ②有OH﹣ |
| 实验 | 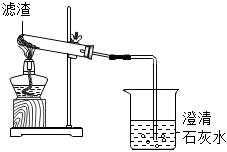 |
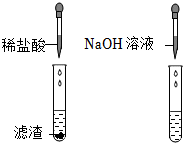 |
| 实验现象 | 澄清石灰水变浑浊,试管口出现较多无色液体 | 加入稀盐酸后,滤渣消失,有气泡生成加入NaOH溶液后,产生 |
| 实验结论 | 滤渣中含有氧元素、 | 滤渣中含有镁元素 |
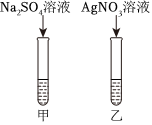
| 实验方案 | 现象 | |
| 小亮 | 加入NaOH溶液 | 无明显现象 |
| 小龙 | 加入BaCl2溶液 | 产生白色沉淀 |
| 小倩 | 加入稀盐酸 | 产生气泡 |
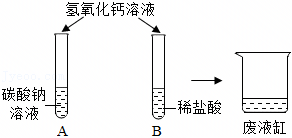
| 操作步骤 | 现象 | 结论 |
| 取少量废液于试管中,向其中滴加Na2CO3溶液 | 猜想②成立 |

gg@dyw.com
2024-03-02
初中化学 | | 实验探究题