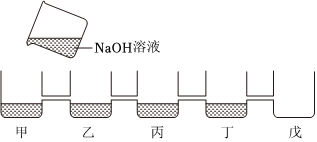
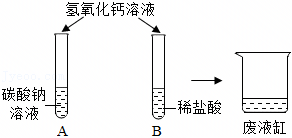
[考点]
实验探究物质的组成成分以及含量,酸的化学性质,
[答案]
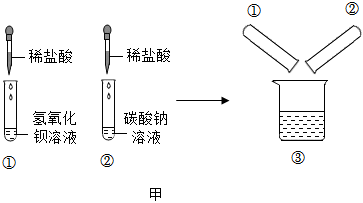
【作出猜想】BaCl2和HCl。
【讨论交流】Ba(OH)2+2HCl═BaCl2+2H2O。
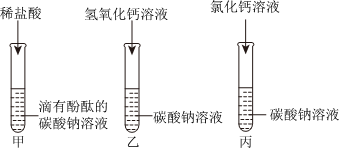
【进行实验】一;先产生气泡后产生沉淀。
【实验结论】氢离子和氢氧根离子结合生成水分子。
【反思拓展】(1)反应物是否过量。
(2)bc。
[解析]
解:【作出猜想】猜想一:可能是BaCl2和Ba(OH)2;猜想二:可能只有BaCl2;猜想三:可能是BaCl2、Ba(OH)2和HCl;猜想四:可能是BaCl2和HCl。
故答案为:BaCl2和HCl。
【讨论交流】小组同学讨论分析后发现猜想三不合理,原因是氢氧化钡和盐酸反应生成氯化钡和水,反应的化学方程式:Ba(OH)2+2HCl═BaCl2+2H2O。
故答案为:Ba(OH)2+2HCl═BaCl2+2H2O。
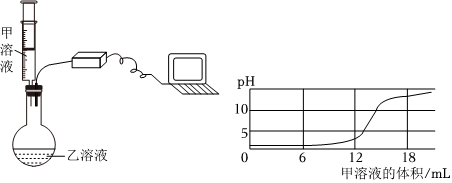
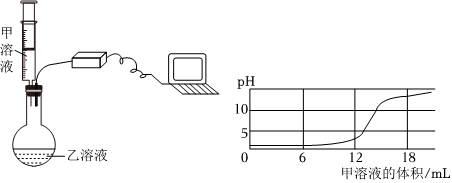
【进行实验】步骤I.取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡,观察到溶液仍为无色,说明溶液中不含有氢氧化钡,猜想一不正确。
步骤Ⅱ.另取少量烧杯内溶液于试管中,逐滴加入碳酸钠溶液至过量,整个过程中观察到的现象是先产生气泡(盐酸和碳酸钠反应生成氯化钠、水和二氧化碳)后产生沉淀(氯化钡和碳酸钠反应生成白色沉淀碳酸钡和氯化钠),说明猜想四正确。
故答案为:一;先产生气泡后产生沉淀。
【实验结论】酸碱中和反应的微观实质是氢离子和氢氧根离子结合生成水分子。
故答案为:氢离子和氢氧根离子结合生成水分子。
【反思拓展】(1)在分析反应后所得物质成分时,除考虑生成物外,还需考虑反应物是否过量。
故答案为:反应物是否过量。
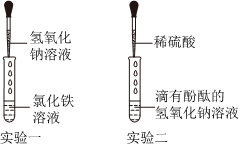
(2)若猜想一正确,欲验证该猜想,可以选用下列提供的氯化铁溶液(氯化铁和氢氧化钡反应生成红褐色沉淀氢氧化铁和氯化钡)、二氧化碳(二氧化碳和氢氧化钡反应生成白色沉淀碳酸钡和水)。
故答案为:bc。
[点评]
本题考查了"实验探究物质的组成成分以及含量,酸的化学性质,",属于"必考题",熟悉题型是解题的关键。