[考点]
实验探究物质的组成成分以及含量,酸的化学性质,碱的化学性质,
[答案]
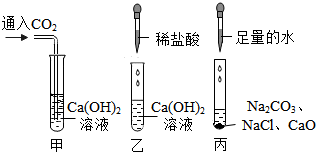
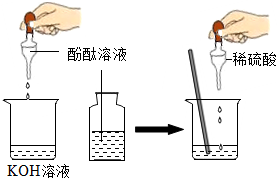
(1)溶液由红色变为无色;Ca(OH)2+2HCl=CaCl2+2H2O;
(2)CaCl2、Ca(OH)2;
(3)稀盐酸和氢氧化钙能反应,不能共存;
(4)碳酸钠;有气泡产生;
(5)碳酸钙。
[解析]
解:(1)氢氧化钙溶液中加入酚酞,溶液变红色,滴入稀盐酸后,稀盐酸和氢氧化钙反应生成氯化钙和水,反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O,溶液由红色变为无色;
(2)稀盐酸和氢氧化钙反应生成氯化钙和水,恰好完全反应时,猜想一:CaCl2,稀盐酸过量时,猜想二:CaCl2、HCl,氢氧化钙溶液过量时,猜想四:CaCl2、Ca(OH)2;
(3)由于稀盐酸和氢氧化钙能反应,不能共存,所以猜想三不合理;
(4)猜想二正确,即溶质为氯化钙和稀盐酸,现象是先有气泡产生,后有白色沉淀生成,碳酸钠先和盐酸反应生成二氧化碳气体,再和氯化钙反应生成碳酸钙白色沉淀,则加入的物质可以是碳酸钠溶液,锌和盐酸反应生成氯化锌和氢气,观察到有气泡冒出;
(5)溶质为氯化钙和稀盐酸,可以加入过量的碳酸钙,因为碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,然后过滤即可。
故答案为:(1)溶液由红色变为无色;Ca(OH)2+2HCl=CaCl2+2H2O;
(2)CaCl2、Ca(OH)2;
(3)稀盐酸和氢氧化钙能反应,不能共存;
(4)碳酸钠;有气泡产生;
(5)碳酸钙。
[点评]
本题考查了"实验探究物质的组成成分以及含量,酸的化学性质,碱的化学性质,",属于"难典题",熟悉题型是解题的关键。
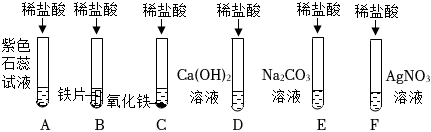
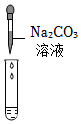
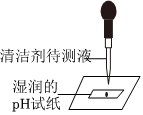
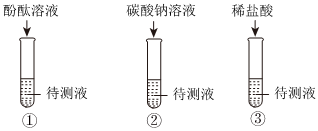 学习小组的同学和老师一起整理实验台时,发现有一瓶失去标签的无色溶液,据老师回忆,可能是NaOH溶液或Ca(OH)2溶液,为了鉴别该无色溶液,同学们进行如下实验:
学习小组的同学和老师一起整理实验台时,发现有一瓶失去标签的无色溶液,据老师回忆,可能是NaOH溶液或Ca(OH)2溶液,为了鉴别该无色溶液,同学们进行如下实验: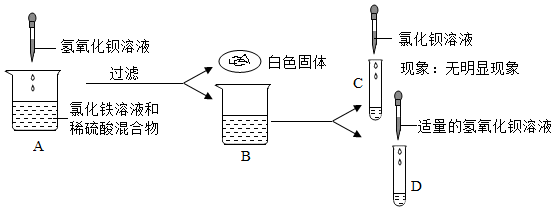
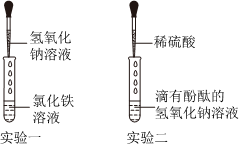
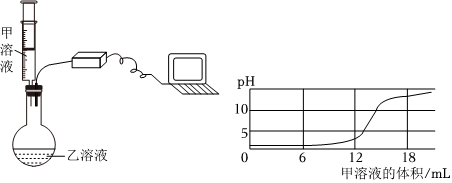
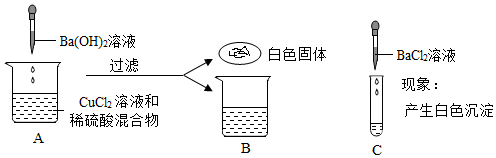
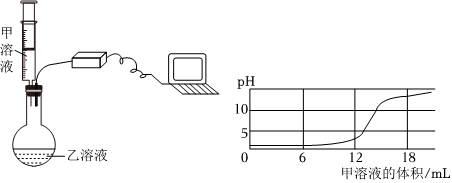
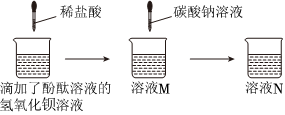 某兴趣小组的同学们以“稀盐酸与氢氧化钡溶液能否反应”为课题进行科学探究。
某兴趣小组的同学们以“稀盐酸与氢氧化钡溶液能否反应”为课题进行科学探究。