[考点]
实验探究物质的组成成分以及含量,酸的化学性质,碱的化学性质,
[解析]
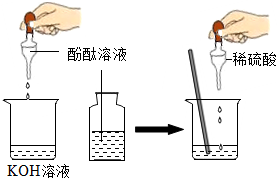
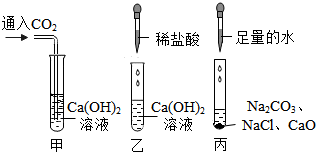
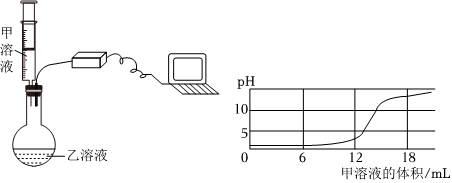
解:氢氧化钙与稀盐酸反应生成氯化钙和水,反应方程式Ca(OH)2+2HCl=CaCl2+H2O,故填:Ca(OH)2+2HCl=CaCl2+H2O;
【提出猜想】因为氢氧化钙与稀盐酸反应生成氯化钙和水,当氢氧化钙与稀盐酸恰好反应时反应后的溶液中的溶质是CaCl2,当盐酸过量时反应后的溶液中的溶质是CaCl2和HCl,当氢氧化钙过量时反应后的溶液中的溶质是CaCl2和Ca(OH)2,所以猜想四CaCl2;猜想三CaCl2、HCl和Ca(OH)2,其中HCl和Ca(OH)2还能继续反应,不能共存,故填:CaCl2;HCl和Ca(OH)2还能继续反应,不能共存;
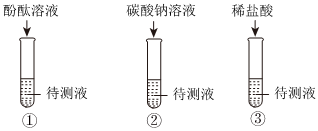
【设计方案】①依据实验操作取少量反应后的溶液于试管中,滴加酚酞试液,实验结论猜想一:CaCl2和Ca(OH)2不成立,所以实验现象是无明显现象,故填:无明显现象;
②因为实验现象是无气泡产生,实验结论是猜想二:CaCl2和HCl不成立,所以实验操作是所加的试剂是碳酸钠溶液;故填:碳酸钠;
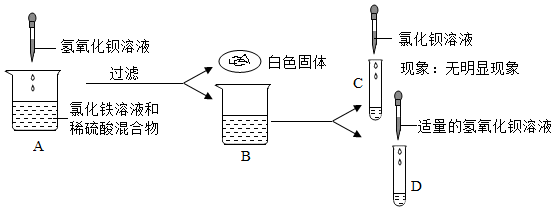
【拓展与应用】(1)因为硝酸银溶液与溶液中溶质反应的实质是Ag++Cl﹣=AgCl↓;即硝酸银与氯化钙和盐酸都能产生白色沉淀,故填:不正确,硝酸银与氯化钙和盐酸都能产生白色沉淀;
(2)反应后的溶质一定含有生成物,若某一反应物过量还会含有过量的反应物,所以在判断反应后所得物质成分时,除了要考虑生成物以外,还要考虑反应物是否过量的问题,故填:反应物是否过量。
[点评]
本题考查了"实验探究物质的组成成分以及含量,酸的化学性质,碱的化学性质",属于"综合题",根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论是解题的关键。
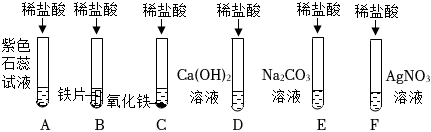
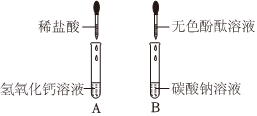 学习小组同学进行了如图所示的实验,并展开了拓展学习与探究。
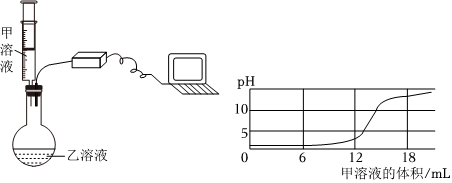
学习小组同学进行了如图所示的实验,并展开了拓展学习与探究。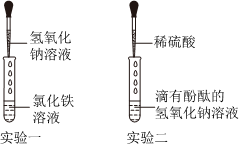
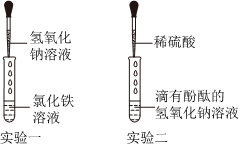
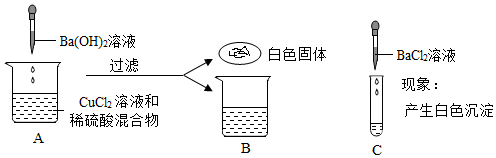
 学习小组的同学和老师一起整理实验台时,发现有一瓶失去标签的无色溶液,据老师回忆,可能是NaOH溶液或Ca(OH)2溶液,为了鉴别该无色溶液,同学们进行如下实验:
学习小组的同学和老师一起整理实验台时,发现有一瓶失去标签的无色溶液,据老师回忆,可能是NaOH溶液或Ca(OH)2溶液,为了鉴别该无色溶液,同学们进行如下实验: