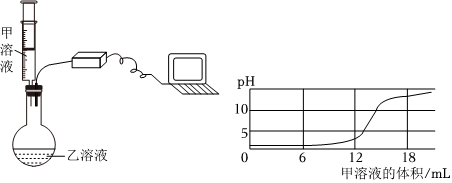
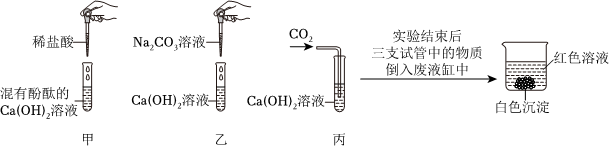
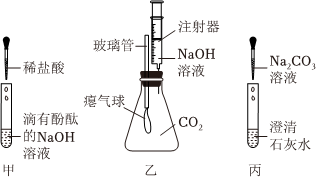
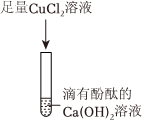
[考点]
实验探究物质的组成成分以及含量,酸的化学性质,碱的化学性质,盐的化学性质,
[答案]
(1)酚酞;
(2)H2SO4+2NaOH=Na2SO4+2H2O;
(3)碳酸钡、硫酸钡;
(4)Na+、Ba2+;
(5)红;
(6)反应物是否过量。
[解析]
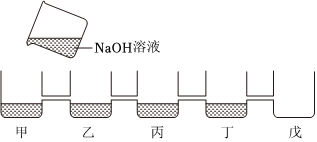
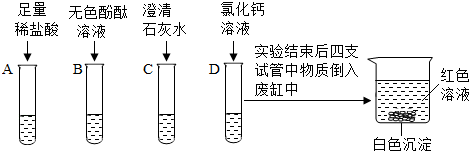
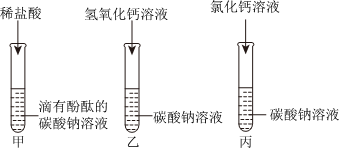
解:(1)氢氧化钠溶液显碱性,能使无色酚酞试液变红,故甲中溶液变红,说明甲中盛放的试剂为酚酞溶液;
(2)氢氧化钠溶液显碱性,能使无色酚酞试液变红,而乙中溶液呈无色,说明乙中溶液为稀硫酸,氢氧化钠和稀硫酸反应生成硫酸钠和水,硫酸钠显中性,稀硫酸显酸性,均不能使无色酚酞试液变色,该反应的化学方程式为H2SO4+2NaOH=Na2SO4+2H2O;
(3)丙中有气泡产生,说明丙中为碳酸钠,乙中反应后,硫酸过量,硫酸和碳酸钠反应生成硫酸钠、二氧化碳和水,故产生气泡,则丁中为氯化钡,丁中的沉淀可能是硫酸钡,也可能是碳酸钡,也可能是硫酸钡和碳酸钡的混合物,向沉淀中加入足量稀硝酸,沉淀部分溶解,有气泡产生,说明丁中的白色沉淀是硫酸钡和碳酸钡,硫酸钡和稀硝酸不反应,碳酸钡和稀硝酸反应生成硝酸钡、二氧化碳和水,则丙中反应后,碳酸钠过量,即反应后,丙中溶液中溶质为硫酸钠和碳酸钠;
(4)向戊容器中溶液加入过量稀硫酸,只有白色沉淀产生,说明溶液中含氯化钡,氯化钡能与硫酸反应生成硫酸钡和盐酸,氯化钡能与硫酸钠、碳酸钠反应,不能共存,则溶液中不含硫酸钠和碳酸钠,硫酸钠、碳酸钠和氯化钡反应生成了氯化钠,故戊容器中的溶液中的溶质为氯化钠和氯化钡,戊中溶液含有的阳离子有:Na+、Ba2+;
(5)由以上分析可知,丙中溶液含硫酸钠和碳酸钠,碳酸钠溶液显碱性,能使无色酚酞试液变红,故溶液呈红色;
(6)由以上分析可知,分析反应后溶液溶质成分时,除考虑生成物外,还应考虑反应物是否过量。
故答案为:(1)酚酞;
(2)H2SO4+2NaOH=Na2SO4+2H2O;
(3)碳酸钡、硫酸钡;
(4)Na+、Ba2+;
(5)红;
(6)反应物是否过量。
[点评]
本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。