[考点]
探究酸碱的主要性质,实验探究物质的组成成分以及含量,碱的化学性质,中和反应及其应用,书写化学方程式、文字表达式、电离方程式,
[答案]
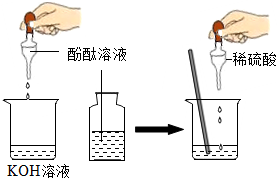
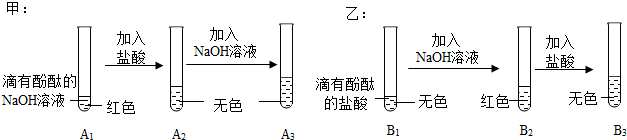
(1)溶液由红色变为无色;
(2)CO2+2NaOH=Na2CO3+H2O;
(3)【猜想】氢氧化钠和碳酸钠;
【验证】氯化钙;溶液变为无色;
【反思】不能。
[解析]
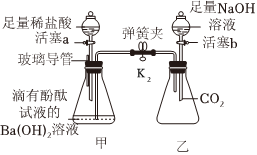
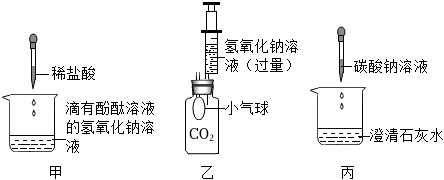
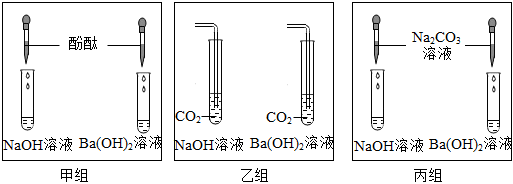
解:(1)氢氧化钡溶液显碱性,能使无色酚酞试液变红,滴加稀盐酸,氢氧化钡和稀盐酸反应生成氯化钡和水,氯化钡显中性,不能使无色酚酞试液变红,故当观察到溶液由红色变为无色时,说明氢氧化钡溶液与稀盐酸恰好完全反应;
(2)氢氧化钠和二氧化碳反应生成碳酸钠和水,该反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O;
(3)【猜想】甲锥形瓶中,氢氧化钡和稀盐酸恰好完全反应生成氯化钡和水,乙锥形瓶中,二氧化碳和氢氧化钠反应生成碳酸钠和水,氢氧化钠足量,打开弹簧夹,乙瓶中二氧化碳被消耗,装置内压强减小,故甲瓶中的液体进入乙瓶中,氯化钡和碳酸钠反应生成碳酸钡和氯化钠,反应后,乙锥形瓶内的溶液呈红色且有白色沉淀产生,溶液呈红色,说明溶液显碱性,故溶液中可能含氢氧化钠,也可能含碳酸钠,也可能含氢氧化钠和碳酸钠的混合物,故猜想三:氢氧化钠和碳酸钠;
【验证】结论为猜想二成立,故使溶液显红色的物质是碳酸钠,碳酸钠能与氯化钙反应生成碳酸钙和氯化钠,故将乙中混合液静置,取少量上层清液于试管中,加入足量氯化钙溶液,产生白色沉淀,说明含碳酸钠,且足量的氯化钙溶液能将碳酸钠除尽,反应后,溶液呈无色,说明不含氢氧化钠;
【反思】甲瓶中,氢氧化钡能使无色酚酞试液变红,说明可溶性碱能与酸碱指示剂反应;氢氧化钡能与稀盐酸反应,说明可溶性碱能与酸反应,乙瓶中二氧化碳能与氢氧化钠反应,说明可溶性碱能与非金属氧化物反应,不能验证可溶性碱能与部分盐反应,故不能验证可溶性碱的全部化学性质。
故答案为:(1)溶液由红色变为无色;
(2)CO2+2NaOH=Na2CO3+H2O;
(3)【猜想】氢氧化钠和碳酸钠;
【验证】氯化钙;溶液变为无色;
【反思】不能。
[点评]
本题考查了"探究酸碱的主要性质,实验探究物质的组成成分以及含量,碱的化学性质,中和反应及其应用,书写化学方程式、文字表达式、电离方程式,",属于"压轴题",熟悉题型是解题的关键。

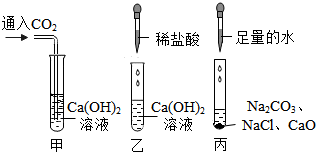
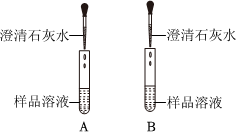 学习小组同学用澄清的石灰水鉴别失去标签的碳酸钠溶液和氢氧化钠溶液。并展开了拓展学习与探究。
学习小组同学用澄清的石灰水鉴别失去标签的碳酸钠溶液和氢氧化钠溶液。并展开了拓展学习与探究。