[考点]
实验探究物质的组成成分以及含量,碱的化学性质,盐的化学性质,书写化学方程式、文字表达式、电离方程式,
[答案]
(1)固体逐渐减少,有气泡生成;
(2)步骤②中加入的氢氧化钠溶液可能被步骤①中过量的稀盐酸完全反应,也无明显现象,不能验证溶液中是否含有Mg(OH)2;
(3)排尽装置内的空气,防止空气中的二氧化碳和水干扰实验结果测定;
(4)CO2+2NaOH=Na2CO3+H2O;
(5)吸收空气中的二氧化碳和水,防止空气中的二氧化碳和水进入装置C、D,干扰实验结果测定;食醋。
[解析]
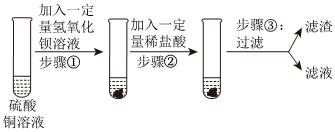
解:(1)根据实验结论猜想二不成立,结合猜想一、猜想三说明白色固体中含有碳酸钙,则取少量白色固体于试管中,加入过量稀盐酸,稀盐酸与碳酸钙反应生成氯化钙、二氧化碳和水,实验现象为有气泡生成,说明水垢成分中含有碳酸钙,则猜想二不成立;
(2)已知氯化钙与氢氧化钠的稀溶液不发生反应,步骤①中加入过量稀盐酸,充分反应后溶液中可能含有氯化钙、氯化氢、氯化镁,步骤②向①反应后的试管中加入2~3滴NaOH溶液,加入的氢氧化钠溶液可能被过量的稀盐酸完全反应,也无明显现象,不能验证溶液中是否含有Mg(OH)2;
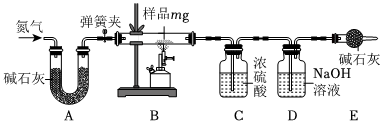
(3)步骤②中缓慢通入氮气目的是排尽装置内的空气,防止空气中的二氧化碳和水干扰实验结果测定;
(4)据上述探究过程可知水垢中含有氢氧化镁和碳酸钙,氢氧化镁受热分解生成水和氧化镁,碳酸钙在高温条件下分解生成氧化钙、二氧化碳,因此装置D中发生的反应是二氧化碳与氢氧化钠反应生成碳酸钠和水,化学方程式为CO2+2NaOH=Na2CO3+H2O;
(5)装置E的作用是吸收空气中的二氧化碳和水,防止空气中的二氧化碳和水进入装置C、D,干扰实验结果测定;水垢中含有氢氧化镁和碳酸钙,厨房中的食醋中含有醋酸,可与氢氧化镁、碳酸钙反应,因此可使用厨房中的食醋除去水垢。
故答案为:(1)固体逐渐减少,有气泡生成;
(2)步骤②中加入的氢氧化钠溶液可能被步骤①中过量的稀盐酸完全反应,也无明显现象,不能验证溶液中是否含有Mg(OH)2;
(3)排尽装置内的空气,防止空气中的二氧化碳和水干扰实验结果测定;
(4)CO2+2NaOH=Na2CO3+H2O;
(5)吸收空气中的二氧化碳和水,防止空气中的二氧化碳和水进入装置C、D,干扰实验结果测定;食醋。
[点评]
本题考查了"实验探究物质的组成成分以及含量,碱的化学性质,盐的化学性质,书写化学方程式、文字表达式、电离方程式,",属于"综合题",熟悉题型是解题的关键。
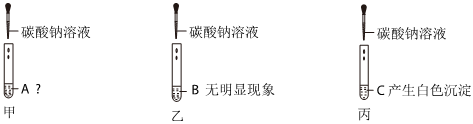
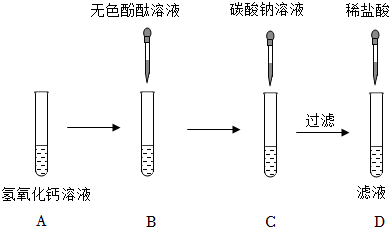
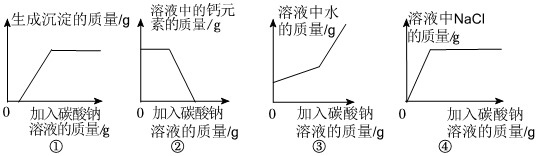
 学习小组同学用澄清的石灰水鉴别失去标签的碳酸钠溶液和氢氧化钠溶液。并展开了拓展学习与探究。
学习小组同学用澄清的石灰水鉴别失去标签的碳酸钠溶液和氢氧化钠溶液。并展开了拓展学习与探究。
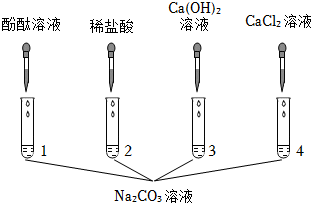 ?
?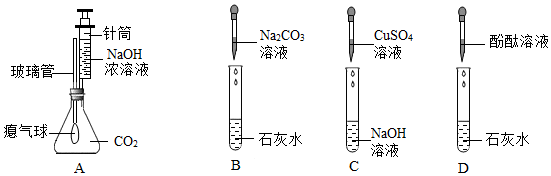
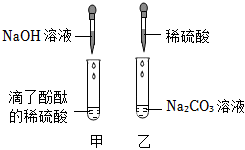
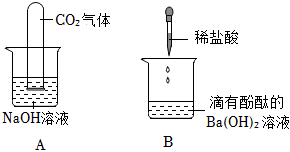 实验课上,某化学小组探究两个初中常见的无明显现象的反应:甲同学利用装置A将装满CO2的试管倒扣在盛有NaOH溶液的烧杯中,乙同学借助无色酚酞溶液利用装置B进行中和反应,如图所示:
实验课上,某化学小组探究两个初中常见的无明显现象的反应:甲同学利用装置A将装满CO2的试管倒扣在盛有NaOH溶液的烧杯中,乙同学借助无色酚酞溶液利用装置B进行中和反应,如图所示: