[考点]
实验探究物质的组成成分以及含量,碱的化学性质,盐的化学性质,书写化学方程式、文字表达式、电离方程式,
[答案]
(1)有白色沉淀生成;
【做出猜想】NaOH、Ca(OH)2;
(2)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(3)气泡;盐酸会先与氢氧化钠反应;
(4)A。
[解析]
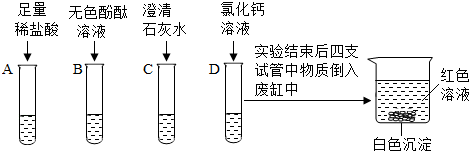
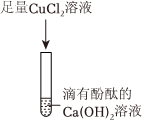
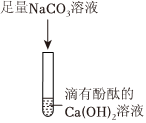
解:(1)澄清石灰水的主要成分是氢氧化钙,氢氧化钙和碳酸钠反应会生成碳酸钙,若B中看到有白色沉淀生成,说明B中的物质是碳酸钠溶液;
【做出猜想】氢氧化钙和碳酸钠反应会出现三种情况。其一,两溶液恰好完全反应,反应后的溶液中只有氢氧化钠;其二,碳酸钠过量,溶液中除反应生成的氢氧化钠,还含有未反应的碳酸钠;其三,澄清石灰水过量,溶液中除反应生成的氢氧化钠溶液中还含有未反应的氢氧化钙,结合甲、乙同学的猜想,丙同学的猜想为:含有NaOH、Ca(OH)2;
(2)丁同学的猜想不合理,是因为氢氧化钙和碳酸钠会反应生成碳酸钙和氢氧化钠,不能共存,反应的化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
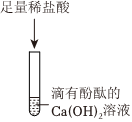
(3)碳酸钠和稀盐酸反应会生成二氧化碳,所以戊同学取少量滤液于试管中,再加入过量的稀盐酸一段时间后观察到有气泡产生;戊同学的实验现象证明乙的猜想成立,实验过程中需要加过量盐酸,是因为盐酸会先与氢氧化钠反应,如加入稀盐酸过少则不能看到稀盐酸和碳酸钠反应的现象;
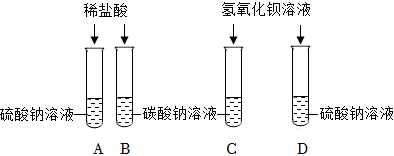
(4)A、盐酸可与氢氧化钠和碳酸钠发生反应,故选项符合题意;
B、氯化钙不能和氢氧化钠反应,故选项不符合题意;
C、氢氧化钙不能和氢氧化钠反应,故选项不符合题意。
故答案为:(1)有白色沉淀生成;
【做出猜想】NaOH、Ca(OH)2;
(2)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(3)气泡;盐酸会先与氢氧化钠反应;
(4)A。
[点评]
本题考查了"实验探究物质的组成成分以及含量,碱的化学性质,盐的化学性质,书写化学方程式、文字表达式、电离方程式,",属于"综合题",熟悉题型是解题的关键。
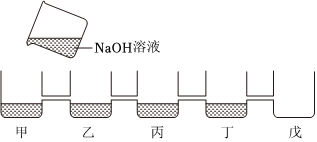
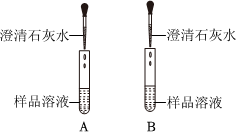 学习小组同学用澄清的石灰水鉴别失去标签的碳酸钠溶液和氢氧化钠溶液。并展开了拓展学习与探究。
学习小组同学用澄清的石灰水鉴别失去标签的碳酸钠溶液和氢氧化钠溶液。并展开了拓展学习与探究。
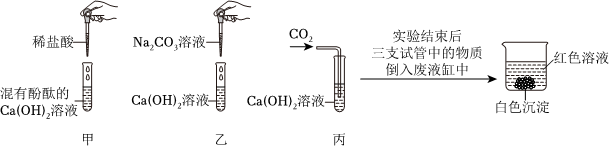
 食盐、纯碱、食醋是家庭厨房中常见的物质,为了将所学知识与实际生活联系在一起,实验小组进行了如下实验探究。
食盐、纯碱、食醋是家庭厨房中常见的物质,为了将所学知识与实际生活联系在一起,实验小组进行了如下实验探究。