[考点]
探究酸碱的主要性质,碱的化学性质,书写化学方程式、文字表达式、电离方程式,
[答案]
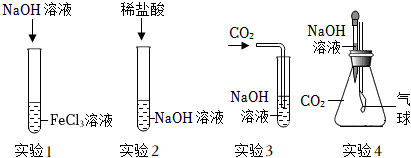
(1)3NaOH+FeCl3=Fe(OH)3↓+3NaCl;
(2)Ⅰ、无明显现象;
Ⅱ、CD;
(3)Ⅰ、Ca(OH)2;
Ⅱ、水;
(4)反应物的消失。
[解析]
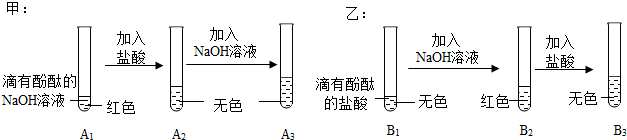
解:(1)实验1的试管中是氯化铁溶液和氢氧化溶液反应生成氢氧化铁沉淀和氯化钠,反应的化学方程式为3NaOH+FeCl3=Fe(OH)3↓+3NaCl;
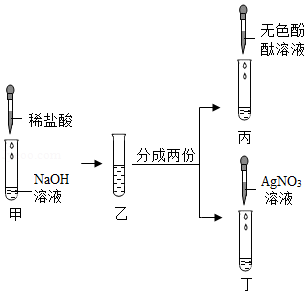
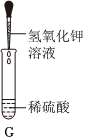
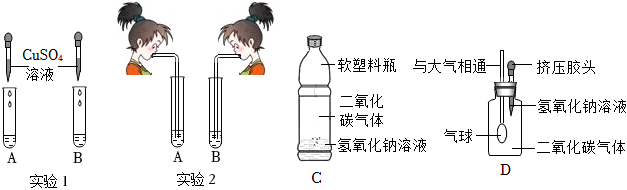
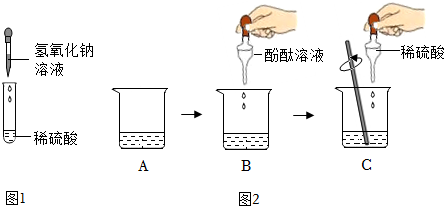
(2)Ⅰ、向反应后的实验2溶液中加入镁粉,镁能与稀盐酸反应生成氯化镁和氢气,若无明显现象,说明稀盐酸消失,则氢氧化钠与稀盐酸发生了化学反应;
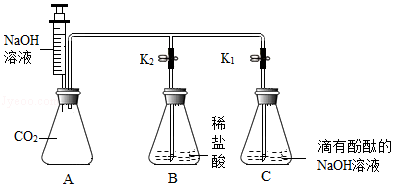
Ⅱ、A、硫酸铜和稀盐酸不反应,无法检验是否含盐酸,是否恰好完全反应,故A不符合题意;
B、硝酸银与盐酸、氯化钠均能反应生成氯化银白色沉淀,无法检验是否恰好完全反应,故B不符合题意;
C、逐滴滴入氢氧化钠溶液,如果恰好完全反应,滴入氢氧化钠溶液,溶液立刻变红,如果稀盐酸过量,滴入氢氧化钠溶液,氢氧化钠先与盐酸反应生成氯化钠和水,故溶液过一会儿变红,故C符合题意;
D、氧化铜能与稀盐酸反应生成氯化铜和水,氧化铜和氯化钠不反应,则加入氧化铜,如果无明显现象,说明恰好完全反应,如果黑色固体逐渐溶液,溶液变为蓝色,则稀盐酸过量,故D符合题意;
故选:CD。
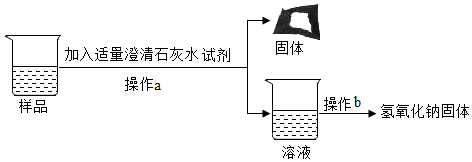
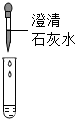
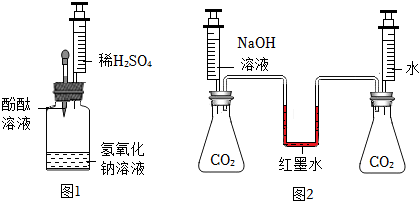
(3)Ⅰ、二氧化碳能与氢氧化钠反应生成碳酸钠和水,则可用验证碳酸钠的生成来证明二氧化碳与氢氧化钠发生了反应,碳酸钠能与稀盐酸反应生成氯化钠、二氧化碳和水,可选择稀盐酸来验证碳酸钠的生成,氯化钙能与碳酸钠反应生成碳酸钙和氯化钠,也可选择氯化钙溶液验证碳酸钠的生成,盐酸属于酸,氯化钙属于盐,氢氧化钙能与碳酸钠反应生成碳酸钙和氢氧化钠,也可选择氢氧化钙验证碳酸钠的生成,且氢氧化钙属于碱,与稀盐酸和氯化钙的物质类别不同,故小明同学所选溶液中的溶质可能是Ca(OH)2;
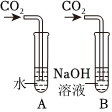
Ⅱ、二氧化碳能溶于水,且与水反应,也能导致装置内气体减少,压强减小,导致气球变大,故还应进行CO2与等体积水的对比实验,排除水的干扰;
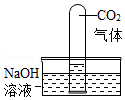
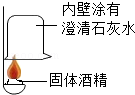
(4)对于无明显现象的化学反应,可以通过检验有新物质生成或检验反应物的消失(实验4就是证明反应物二氧化碳消失)的方法来证明反应发生了。
故答案为:(1)3NaOH+FeCl3=Fe(OH)3↓+3NaCl;
(2)Ⅰ、无明显现象;
Ⅱ、CD;
(3)Ⅰ、Ca(OH)2;
Ⅱ、水;
(4)反应物的消失。
[点评]
本题考查了"探究酸碱的主要性质,碱的化学性质,书写化学方程式、文字表达式、电离方程式,",属于"难典题",熟悉题型是解题的关键。