[考点]
实验探究物质的组成成分以及含量,酸的化学性质,碱的化学性质,书写化学方程式、文字表达式、电离方程式,
[答案]
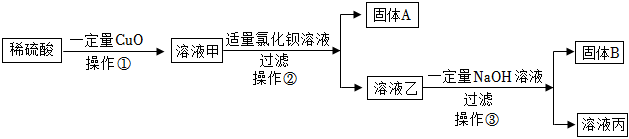
(1)改良酸性土壤;CaO+H2O=Ca(OH)2;
(2)能;
【作出猜想】猜想三、猜想四;
【实验步骤及结论】固体溶解;
【反思评价】Na2CO3。
[解析]
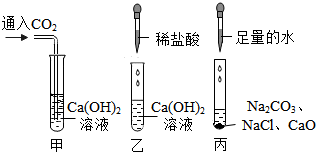
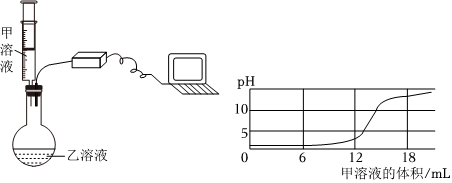
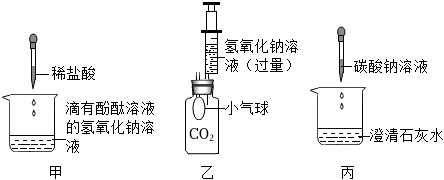
解:(1)熟石灰在农业上可用于改良酸性土壤,丙组实验加水后触摸试管外壁发烫,是氧化钙与水反应生成氢氧化钙放出大量的热,化学方程式为CaO+H2O=Ca(OH)2;
(2)实验乙反应后的溶液中加入无色酚酞溶液,观察到溶液仍为无色,证明溶液呈酸性,氢氧化钙溶液呈碱性,加入稀盐酸后溶液呈酸性,能证明氢氧化钙溶液和盐酸发生了反应;
【作出猜想】实验丙中有碳酸钙沉淀生成,将反应后的废液混合在一起,沉淀消失了,说明碳酸钙与乙中的盐酸反应生成了氯化钙,所以废液中溶质的成分一定有氯化钙,故猜想三、猜想四是错误的;
【实验步骤及结论】比较猜想一和猜想二,即验证溶液中是否含有HCl,取上述废液于试管中,加入一定量的氧氧化镁,固体溶解,则猜想二成立;
【反思评价】探究可知废液的成分是NaCl、CaCl2、HCl,要将上述废液加入一种试剂,并控制好用量,得到只含有一种溶质的溶液,即除去钙离子和氢离子,可加Na2CO3溶液,氯化钙与碳酸钠反应生成氯化钠和碳酸钙沉淀,盐酸和碳酸钠反应生成氯化钠和二氧化碳、水。
故答案为:(1)改良酸性土壤;CaO+H2O=Ca(OH)2;
(2)能;
【作出猜想】猜想三、猜想四;
【实验步骤及结论】固体溶解;
【反思评价】Na2CO3。
[点评]
本题考查了"实验探究物质的组成成分以及含量,酸的化学性质,碱的化学性质,书写化学方程式、文字表达式、电离方程式,",属于"综合题",熟悉题型是解题的关键。
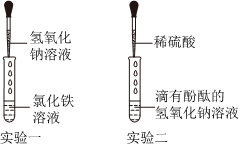
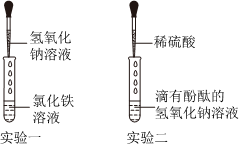
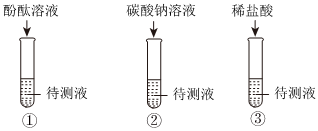 学习小组的同学和老师一起整理实验台时,发现有一瓶失去标签的无色溶液,据老师回忆,可能是NaOH溶液或Ca(OH)2溶液,为了鉴别该无色溶液,同学们进行如下实验:
学习小组的同学和老师一起整理实验台时,发现有一瓶失去标签的无色溶液,据老师回忆,可能是NaOH溶液或Ca(OH)2溶液,为了鉴别该无色溶液,同学们进行如下实验: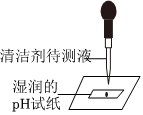
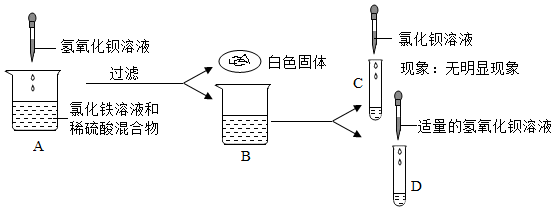
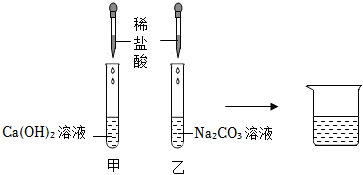
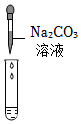
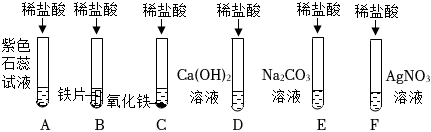
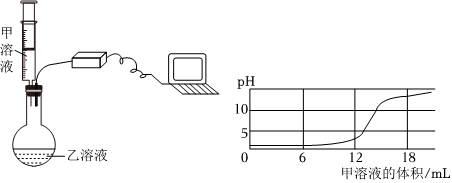
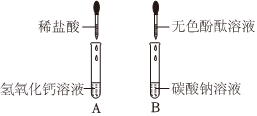 学习小组同学进行了如图所示的实验,并展开了拓展学习与探究。
学习小组同学进行了如图所示的实验,并展开了拓展学习与探究。