[考点]
实验探究物质的组成成分以及含量,酸的化学性质,碱的化学性质,
[答案]
(1)②;
(2)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(3)氯化氢、氯化钙;
(4)四、五;
(5)碳酸钠溶液;
(6)ab。
[解析]
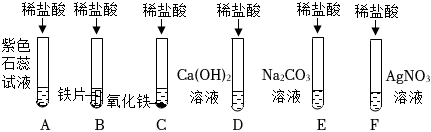
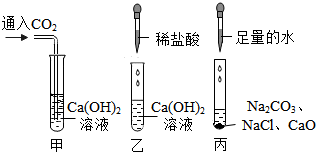
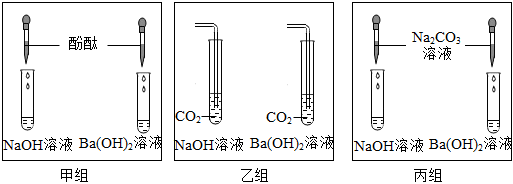
解:(1)氢氧化钠和氢氧化钙溶液均显碱性,均能使无色酚酞变红色,不能鉴别;
碳酸钠能和氢氧化钙反应生成碳酸钙白色沉淀和氢氧化钠,碳酸钠和氢氧化钠不反应,现象不同,可以鉴别;
氢氧化钠和稀盐酸反应生成氯化钠和水,氢氧化钙和稀盐酸反应生成氯化钙和水,均无明显现象,不能鉴别;
故能达到鉴别目的的是试管②;
(2)试管②中,碳酸钠能和氢氧化钙反应生成碳酸钙白色沉淀和氢氧化钠,化学方程式为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
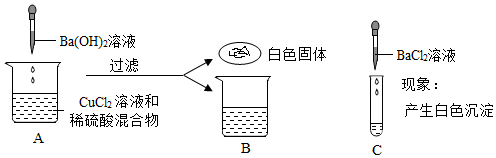
(3)根据观察到的现象,最终确定了该无色溶液为Ca(OH)2溶液;试管①中为滴有酚酞溶液的氢氧化钙溶液;试管②中氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠;试管③中稀盐酸和氢氧化钙反应生成氯化钙和水;实验结束后,将三支试管中的物质全部倒入一个洁净的烧杯中,充分反应后,静置,观察到烧杯中有白色沉淀(碳酸钙沉淀)和无色的上层清液,得到无色上层清液,说明上层清液中一定不含有氢氧化钙、碳酸钠、氢氧化钠,说明试管③中稀盐酸过量,一定发生了③中过量的稀盐酸和②中生成的氢氧化钠反应生成氯化钠和水,则上层清液中一定含有氯化钠;烧杯中有碳酸钙白色沉淀,说明上层清液中一定不含有稀盐酸,由此推测倒入烧杯前试管③中溶质一定有过量的氯化氢和生成的氯化钙;
(4)根据烧杯中得到无色的上层清液,说明一定不含有氢氧化钙(氢氧化钙溶液显碱性,能使无色酚酞溶液变红色),则猜想四不成立;烧杯中有白色沉淀碳酸钙存在,碳酸钙和稀盐酸不能共存,说明上层清液中一定不含有氯化氢,则猜想五不成立;
(5)由(3)分析可知,上层清液中一定含有氯化钠,取上层清液于试管中,加入碳酸钠溶液,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,观察到产生白色沉淀,说明上层清液中一定还含有氯化钙;
(6)总结归纳物质鉴别时的一般思路和方法,需要考虑的a分析待测物质的性质,b待测物性质的差异,不需要考虑 c.了解待测物的用途,故选ab。
故答案为:
(1)②;
(2)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(3)氯化氢、氯化钙;
(4)四、五;
(5)碳酸钠溶液;
(6)ab。
[点评]
本题考查了"实验探究物质的组成成分以及含量,酸的化学性质,碱的化学性质,",属于"难典题",熟悉题型是解题的关键。
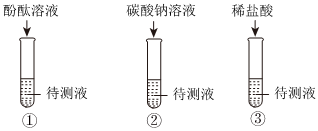 学习小组的同学和老师一起整理实验台时,发现有一瓶失去标签的无色溶液,据老师回忆,可能是NaOH溶液或Ca(OH)2溶液,为了鉴别该无色溶液,同学们进行如下实验:
学习小组的同学和老师一起整理实验台时,发现有一瓶失去标签的无色溶液,据老师回忆,可能是NaOH溶液或Ca(OH)2溶液,为了鉴别该无色溶液,同学们进行如下实验: