[考点]
实验探究物质的组成成分以及含量,酸的化学性质,盐的化学性质,
[答案]
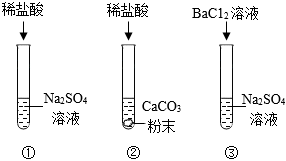
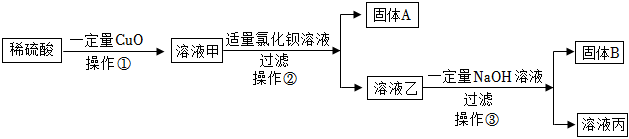
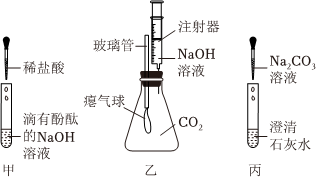
(1)①;
(2)白色粉末溶解,有气泡产生;
(3)BaCl2+Na2SO4=BaSO4↓+2NaCl;
(4)【猜想假设】BaCl2、NaCl;
【设计实验】二;
【反思拓展】bd。
[解析]
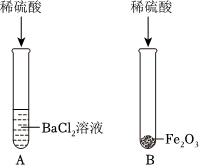
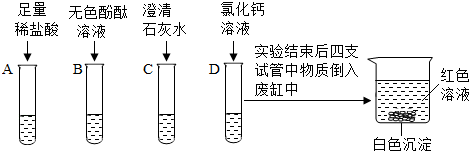
解:(1)复分解反应发生的条件为反应后产物中含有水、气体或沉淀其中至少一种,稀盐酸和硫酸钠溶液中解离出的离子相互结合不能生成水、沉淀或气体,故不能发生复分解反应。
(2)碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳,则试管②中观察到的现象是白色粉末逐渐溶解,溶液中有气泡产生。
(3)试管③中氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,该反应的化学方程式为BaCl2+Na2SO4=BaSO4↓+2NaCl。
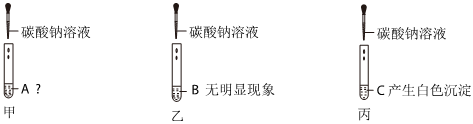
(4)【猜想假设】猜想一:氯化钡和硫酸钠恰好完全反应,反应后滤液中溶质为NaCl;
猜想二:当硫酸钠过量时,反应后滤液中溶质为NaCl、Na2SO4;
猜想三:当氯化钡过量时,反应后滤液中溶质为NaCl、BaCl2。
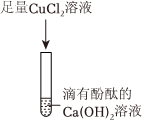
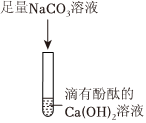
【设计实验】步骤一:取少量滤液于试管中,加入适量BaCl2,溶液无明显现象,说明溶液中不含硫酸钠(氯化钡和硫酸钠反应生成硫酸钡白色沉淀和氯化钠),说明猜想二不成立。
依据复分解反应发生的条件,生成物中有水、气体或沉淀,步骤二中验证猜想三成立,即验证溶液中含有氯化钡。
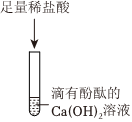
【反思拓展】a.稀盐酸和氯化钡不反应,无明显现象,故a不符合题意;
b.碳酸钠和氯化钡反应生成碳酸钡和氯化钠,现象为产生白色沉淀,故b选项符合题意;
c.硝酸银与氯化钡和氯化钠都能反应生成氯化银白色沉淀,故c选项不符合题意;
d.硫酸铜和氯化钡反应生成硫酸钡和氯化铜,现象为产生白色沉淀,故d选项符合题意。
故选:bd。
故答案为:(1)①;
(2)白色粉末溶解,有气泡产生;
(3)BaCl2+Na2SO4=BaSO4↓+2NaCl;
(4)【猜想假设】BaCl2、NaCl;
【设计实验】二;
【反思拓展】bd。
[点评]
本题考查了"实验探究物质的组成成分以及含量,酸的化学性质,盐的化学性质,",属于"典型题",熟悉题型是解题的关键。