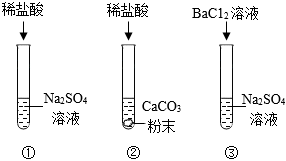
[考点]
实验探究物质的组成成分以及含量,酸的化学性质,
[答案]
【探究一】溶液由红色变为无色;
【探究二】BaCl2;
【分析与交流】(1)Na2CO3+BaCl2=BaCO3↓+2NaCl;
(2)碳酸钠溶液为碱性;
【活动与探究】AB;
【反思交流】反应物是否消失;
【拓展迁移】ABC。
[解析]
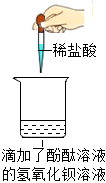
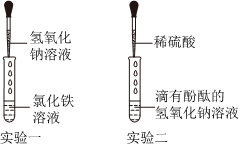
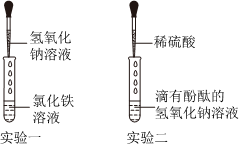
解:【探究一】氢氧化钡能使无色酚酞变红,盐酸和氢氧化钡反应生成氯化钡和水,恰好反应完全反应或酸过量时,溶液变为中性或酸性可使无色酚酞变为无色,故观察到溶液由红色变为无色,说明氢氧化钠消失,得出“稀盐酸与氢氧化钡能发生反应”的结论。
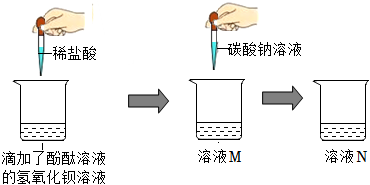
【探究二】向上述实验所得的溶液M中滴加碳酸钠溶液,观察到只生成白色沉淀,溶液不变色。说明溶液M中没有盐酸,因为盐酸与碳酸钠反应生成氯化钠、水和二氧化碳气体;溶液M中没有氢氧化钡,因为氢氧化钡溶液呈碱性,酚酞变红,而上步实验需要溶液变为无色。所以溶液M中只有生成的氯化钡,化学式为BaCl2。
【分析与交流】(1)同学们猜想溶液N中含有NaCl的依据是碳酸钠会与溶液M中的氯化钡反应生成碳酸钡和氯化钠,反应的化学方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl。
(2)猜想三不成立,因为碳酸钠溶液为碱性,如有碳酸钠会使溶液中的酚酞变红。
【活动与探究】猜想中均有氯化钠,则判断溶液是否含有氯化钡即可。
A.碳酸钠和氯化钠不反应,和氯化钡反应生成碳酸钡沉淀和氯化钠,可以判断;
B.硫酸钾和氯化钠不反应,和氯化钡反应生成硫酸钡沉淀和氯化钾,可以判断;
C.稀盐酸和氯化钠、氯化钡都不反应,虽然和碳酸钠反应但已确定猜想三错误无需验证,不可以判断;
D.氯化钙和氯化钠、氯化钡都不反应,虽然和碳酸钠反应但已确定猜想三错误无需验证,不可以判断;
故选:AB。
【反思交流】判断无明显现象的反应发生,可以通过检验新物质的出现,或者通过检验反应物是否消失进行判断,如探究一就是通过检验氢氧化钠消失判断反应发生了。
【拓展迁移】为验证反应后所得溶液中稀盐酸有剩余,
A、氧化铜与盐酸反应生成氯化铜和水,溶液由无色变蓝,可行;
B、溶液中有酚酞,加入1滴氢氧化钠溶液,如溶液变红则盐酸无剩余,如不变红盐酸有剩余,可选;
C、氢氧化镁和盐酸反应生成氯化镁和水,可行;
D、由于氯化钠和盐酸都能和硝酸银反应生产白色沉淀,不可行。
故选:ABC。
故答案为:【探究一】溶液由红色变为无色;
【探究二】BaCl2;
【分析与交流】(1)Na2CO3+BaCl2=BaCO3↓+2NaCl;
(2)碳酸钠溶液为碱性;
【活动与探究】AB;
【反思交流】反应物是否消失;
【拓展迁移】ABC。
[点评]
本题考查了"实验探究物质的组成成分以及含量,酸的化学性质,",属于"必考题",熟悉题型是解题的关键。
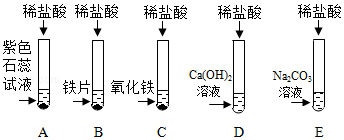
 学习小组的同学和老师一起整理实验台时,发现有一瓶失去标签的无色溶液,据老师回忆,可能是NaOH溶液或Ca(OH)2溶液,为了鉴别该无色溶液,同学们进行如下实验:
学习小组的同学和老师一起整理实验台时,发现有一瓶失去标签的无色溶液,据老师回忆,可能是NaOH溶液或Ca(OH)2溶液,为了鉴别该无色溶液,同学们进行如下实验: