[考点]
实验探究物质的组成成分以及含量,金属的化学性质,酸的化学性质,
[答案]
(1)Zn+H2SO4═ZnSO4+H2↑。
(2)ZnSO4。
(3)二。
(4)CuO。
(5)Ca(OH)2+H2SO4═CaSO4+2H2O。
[解析]
解:(1)根据金属活动性顺序:锌>氢>铜,向盛有锌和铜混合物的烧杯中加入一定量的稀硫酸,铜不反应,锌与稀硫酸反应生成硫酸锌和氢气,该反应方程式为Zn+H2SO4═ZnSO4+H2↑;
(2)根据锌与硫酸反应的情况分析,当锌与硫酸恰好完全反应时,溶质为硫酸锌(ZnSO4),当硫酸有剩余时,所得溶液的溶质为硫酸锌和过量的硫酸;
(3)由于铜不能与硫酸反应,所以溶质不可能含有硫酸铜,故猜想二不合理;
(4)若猜想三正确,即溶质为硫酸锌和硫酸,根据实验现象黑色固体逐渐减少,无色溶液变为蓝色,所以应该是加入黑色的氧化铜(CuO),氧化铜与硫酸反应生成硫酸铜和水,黑色固体逐渐减少,无色溶液变为蓝色,即可得出溶质中含有硫酸,即可证明猜想三正确;
(5)若猜想三正确,即溶质为硫酸锌和硫酸,把该废液倒入铁质下水管道可能造成危害,为消除此废液可能带来的危害,一般会在废液中加入适量的氢氧化钙,经处理后再排放,氢氧化钙与硫酸反应生成硫酸钙和水,该反应方程式为Ca(OH)2+H2SO4═CaSO4+2H2O。
故答案为:(1)Zn+H2SO4═ZnSO4+H2↑。
(2)ZnSO4。
(3)二。
(4)CuO。
(5)Ca(OH)2+H2SO4═CaSO4+2H2O。
[点评]
本题考查了"实验探究物质的组成成分以及含量,金属的化学性质,酸的化学性质,",属于"典型题",熟悉题型是解题的关键。
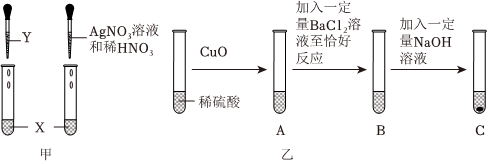
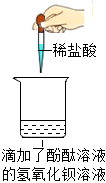
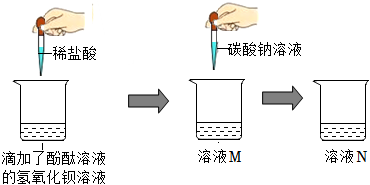
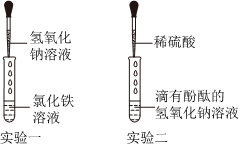
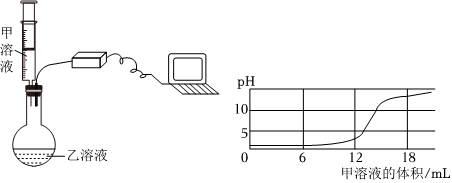
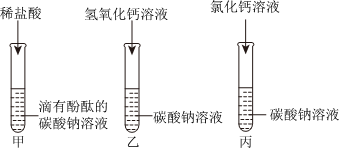
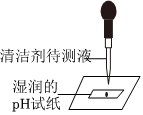
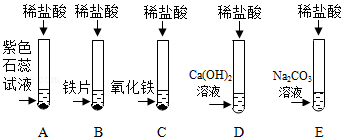
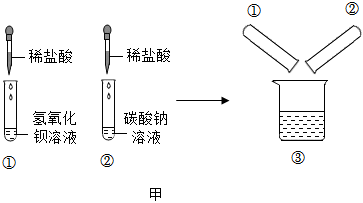
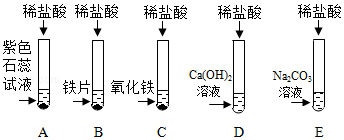
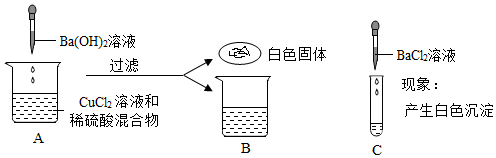
 学习小组同学进行了如图所示的实验,并展开了拓展学习与探究。
学习小组同学进行了如图所示的实验,并展开了拓展学习与探究。