服务热线
搜题▪组卷
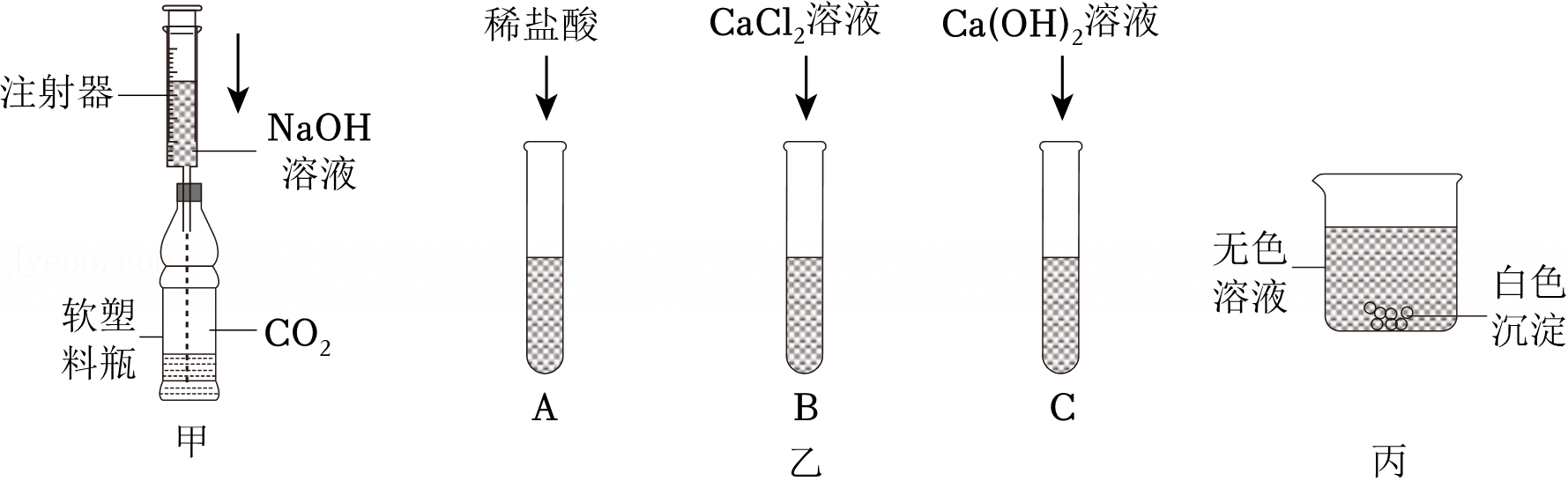
| 实验步骤 | 实验现象 | 猜测 |
| 如图甲,向集满二氧化碳的软塑料瓶中滴加足量的氢氧化钠溶液,振荡 | 猜想一:CO2溶于NaOH溶液中 猜想二:CO2与NaOH反应 |
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取烧杯内无色溶液少许于试管中,滴加过量的 ,静置 | 有白色沉淀生成 | 有 |
| (2)取(1)中反应后的上层清液少许于试管中,滴加硫酸铜溶液。 | 。 | 有OH﹣ |
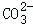

| 实验步骤 | 实验现象 | 实验结论 | |
| 方案一 | ①取少量溶液于试管中,滴加无色酚酞溶液 ②继续滴加稀盐酸 |
①溶液变红 ②产生气泡 |
①有OH﹣ ②有 |
| 方案二 | ①取少量溶液于试管中,滴加足量 溶液 ②继续滴加FeCl3溶液 |
①有白色沉淀生成 ② |
①有 ②有OH﹣ |
| 步骤 | 操作 | 现象 | 结论 |
| ① | 取少量白色滤渣于试管中,滴加足量稀盐酸 | 有气泡产生 | 溶液中无 (填离子符号) |
| ② | 取少量滤液于试管中,滴加稀硫酸 | 溶液中存在Ba2+ | |
| ③ | 取少量滤液于试管中,滴加氯化钡溶液 | 无明显现象 | 溶液中无 |
| ④ | 取少量滤液于试管中,滴加 溶液 | 溶液变红 | 溶液中存在OH﹣ |
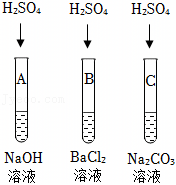
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |
|
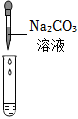
|
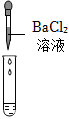
|
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 产生气泡 | |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
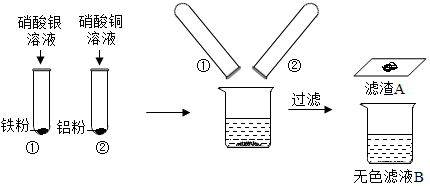
| 样品 | 加入试剂 | 现象 |
| 第一份样品 | 足量 (填名称) | 产生气泡,固体部分溶解,溶液变为浅绿色 |
| 第二份样品 | 足量氢氧化钠溶液 | 现象b |
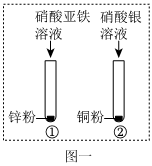
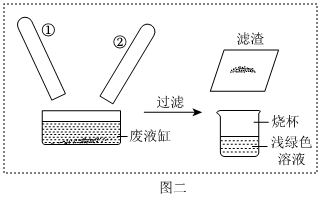
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤渣样品,加入 (填名称) | 有气泡,溶液变成浅绿色。 | 猜想Ⅱ正确 |
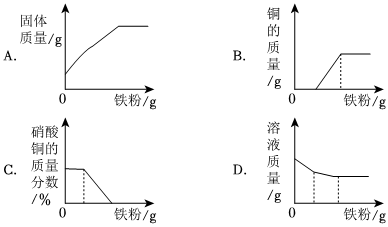
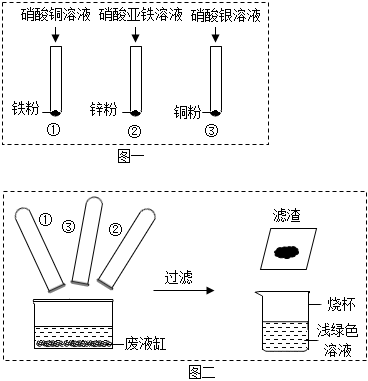
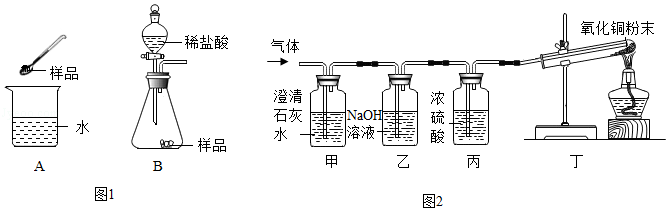
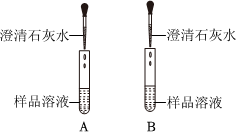 学习小组同学用澄清的石灰水鉴别失去标签的碳酸钠溶液和氢氧化钠溶液。并展开了拓展学习与探究。
学习小组同学用澄清的石灰水鉴别失去标签的碳酸钠溶液和氢氧化钠溶液。并展开了拓展学习与探究。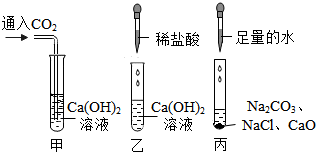
| 实验步骤 | 实验现象 | 实验结论 |
| 取上述废液于试管中,加入一定量的氢氧化镁 | 猜想二成立 |
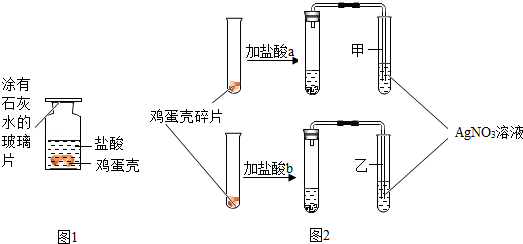
| 实验方案 | 实验现象 | 实验结论 |
| ①取少量白色固体于试管中,加入过量稀盐酸 | 猜想二不成立 | |
| ②向①反应后的试管中加入2~3滴NaOH溶液 | 无明显现象 | 猜想一成立 |
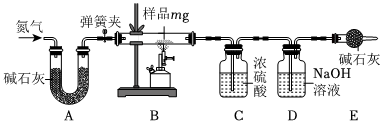
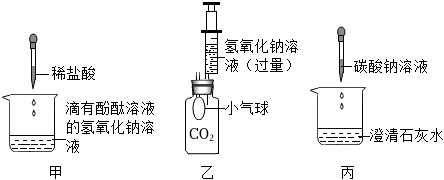
| 方案 |  |
 |
| 现象 | 溶液变红 | 产生 白色沉淀 |
| 结论 | 清液中有氢氧化钠 | 清液中有碳酸钠 |

wpo@dyw.com
2023-04-11
初中化学 | | 实验探究题