[考点]
实验探究物质的组成成分以及含量,金属与盐溶液反应的图像问题,书写化学方程式、文字表达式、电离方程式,
[答案]
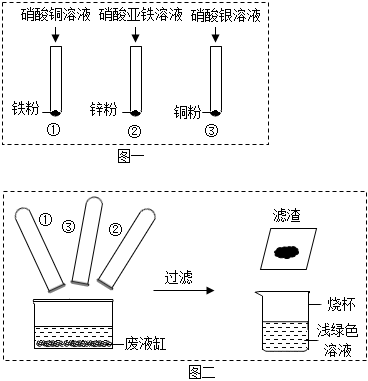
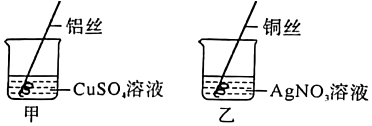
(1)有红色固体析出,溶液由蓝色变为浅绿色;
(2)能;
(3)Zn(NO3)2;
(4)Fe+2HCl=FeCl2+H2↑。
[解析]
解:(1)试管①中,铁能与硫酸铜反应生成铜和硫酸亚铁,铜为紫红色,硫酸铜溶液为蓝色,硫酸亚铁溶液为浅绿色,则实验现象为有红色固体析出,溶液由蓝色变为浅绿色。
(2)试管①说明铁比铜活泼,试管②中锌能与硫酸亚铁反应,锌比铁活泼,试管③中铜能与硝酸银反应,则说明铜比银活泼,则三个实验结合,可说明金属活动性强弱:锌>铁>铜>银。
(3)将铁放入浅绿色滤液中,没有明显变化,则说明滤液中不含硝酸铜和硝酸银。溶液为浅绿色,说明含有硝酸亚铁,锌最活泼,所以滤液中一定有硝酸锌,化学式Zn(NO3)2。
(4)猜想III中含有铁,由于铁能与盐酸反应生成氯化亚铁和氢气,反应的化学方程式为Fe+2HCl=FeCl2+H2↑。
故答案为:(1)有红色固体析出,溶液由蓝色变为浅绿色;
(2)能;
(3)Zn(NO3)2;
(4)Fe+2HCl=FeCl2+H2↑。
[点评]
本题考查了"实验探究物质的组成成分以及含量,金属与盐溶液反应的图像问题,书写化学方程式、文字表达式、电离方程式,",属于"典型题",熟悉题型是解题的关键。