[考点]
实验探究物质的组成成分以及含量,溶液的酸碱度测定,根据酸的通性推断物质的性质,根据碱的通性推断物质的性质,书写化学方程式、文字表达式、电离方程式,
[答案]
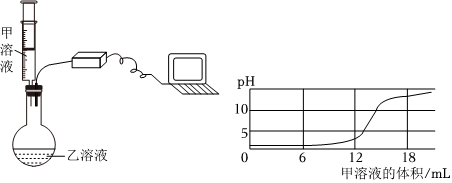
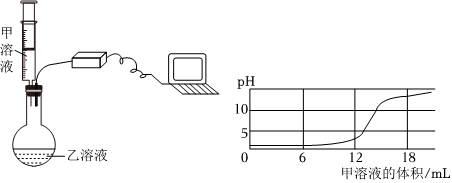
【学生板演】H2SO4+2NaOH═Na2SO4+2H2O;
【假设猜想】酸碱不能共存,会继续反应;
【实验探究】(1)NaOH;
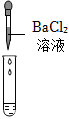
(2)产生白色沉淀;
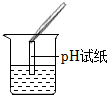
【评价反思】(1)pH试纸直接浸入溶液中;
(2)BaCl2与Na2SO4反应也会生成白色沉淀,不能证明一定有H2SO4存在(其他合理答案均可)。
[解析]
解:【学生板演】根据硫酸和氢氧化钠反应生成硫酸钠和水,故化学方程式为H2SO4+2NaOH═Na2SO4+2H2O;
【假设猜想】根据硫酸和氢氧化钠反应生成硫酸钠和水,酸或碱可能过量:当H2SO4过量时,猜想二:有Na2SO4和H2SO4合理;当氢氧化钠过量时,反应后溶液中的溶质为硫酸钠和氢氧化钠,故猜想三合理;而猜想四为有Na2SO4、H2SO4和NaOH,酸碱不能同时过量,因为酸碱不能共存,会继续反应,故猜想四不合理;
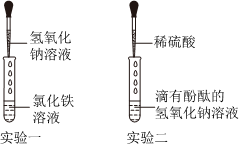
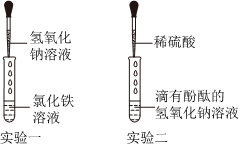
【实验探究】(1)硫酸铜和氢氧化钠反应能生成氢氧化铜蓝色沉淀,因此溶液中滴加几滴CuSO4溶液,无明显变化,说明溶液中一定没有氢氧化钠;
(2)溶液中有硫酸,滴加BaCl2溶液后,BaCl2会和硫酸反应生成白色的硫酸钡沉淀;
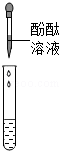
【评价反思】(1)根据图示操作判断,检测溶液的pH时,pH试纸不能伸入溶液中,应用玻璃棒蘸取少量溶液涂到pH试纸上;
(2)检验一种物质时要排除其他物质的干扰,硫酸钠也能与氯化钡反应生成白色沉淀,故不能证明溶液中一定存在硫酸;
故答案为:【学生板演】H2SO4+2NaOH═Na2SO4+2H2O;
【假设猜想】酸碱不能共存,会继续反应;
【实验探究】(1)NaOH;
(2)产生白色沉淀;
【评价反思】(1)pH试纸直接浸入溶液中;
(2)BaCl2与Na2SO4反应也会生成白色沉淀,不能证明一定有H2SO4存在(其他合理答案均可)。
[点评]
本题考查了"实验探究物质的组成成分以及含量,溶液的酸碱度测定,根据酸的通性推断物质的性质,根据碱的通性推断物质的性质,书写化学方程式、文字表达式、电离方程式,",属于"压轴题",熟悉题型是解题的关键。