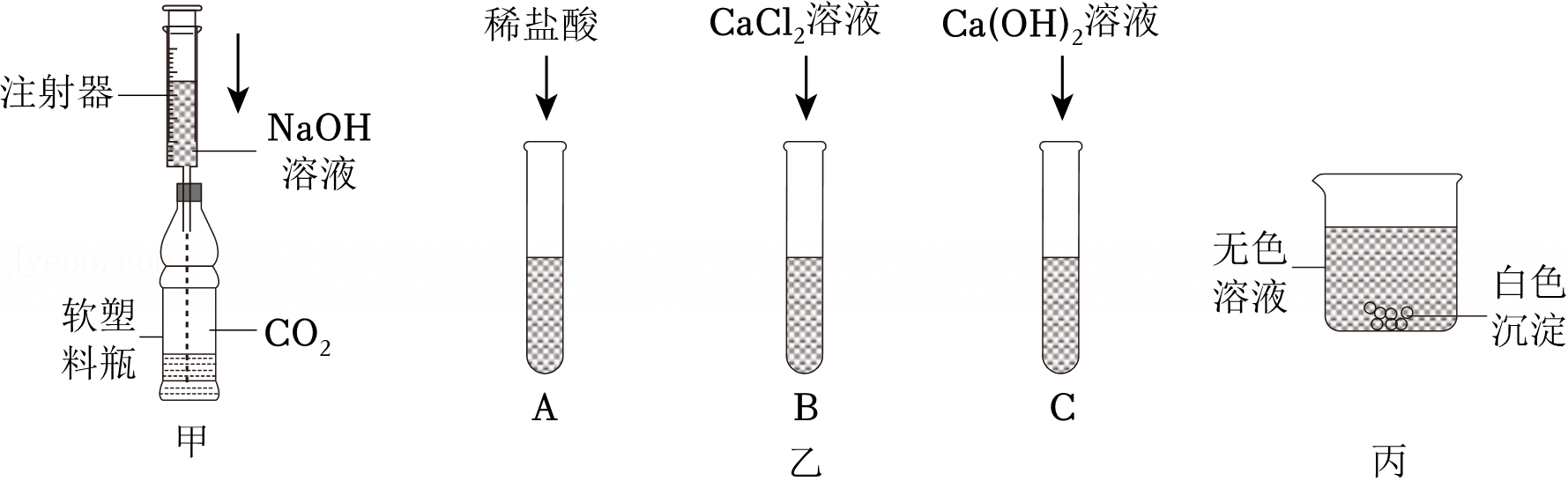
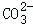[考点]
实验探究物质的组成成分以及含量,常见离子的检验方法及现象,
[答案]
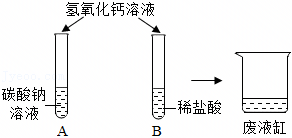
(1)Na2CO3+CaCl2=CaCO3↓+2NaCl或Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(2)氢离子;氯化钡;有红褐色沉淀生成;
(3)碳酸钠溶液显碱性;
(4)①。
[解析]
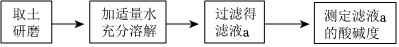
解:(1)碳酸钠与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,氢氧化钙溶液与碳酸钠溶液反应生成碳酸钙沉淀和氢氧化钠,碳酸钙是白色沉淀,实验中生成白色沉淀的化学方程式是Na2CO3+CaCl2=CaCO3↓+2NaCl、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
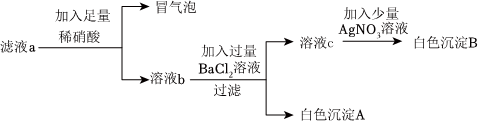
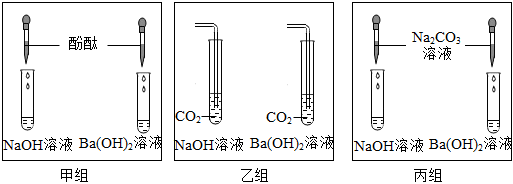
(2)将六支试管中的剩余物倒入一个洁净的大烧杯中(如图),充分搅拌、静置,观察到杯内上层是无色溶液,下层有白色沉淀,白色沉淀是碳酸钙,碳酸钙与氢离子不能共存,由此可以确定上层溶液中一定不含的离子是氢离子,取少量溶液于试管中,滴加足量某溶液,实验现象是有白色沉淀生成,实验结论是有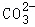 、无Ca2+,碳酸钠与氯化钡溶液反应有白色沉淀生成,则滴加足量某溶液是氯化钡溶液,继续滴加FeCl3溶液,实验结论是有氢氧根离子,氢氧根离子与铁离子结合生成红褐色沉淀,则实验现象是有红褐色沉淀生成;
(3)小明同学对方案提出质疑,他的理由是碳酸钠溶液显碱性,也能使酚酞试液变红色,因此不能确定溶液中是否含有氢氧根离子;
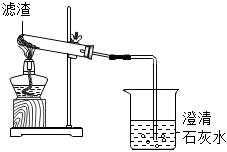
(4)滤液中含有碳酸根离子和氢氧根离子,
①向滤液中加入适量稀盐酸可以除去氢氧根离子和碳酸根离子,进行处理后再排放,故①符合题意;
②向滤液中加入适量的熟石灰,除去碳酸根离子同时有氢氧根离子生成,不能除去氢氧根离子,故②不符合题意;
③向滤液中加入适量硫酸铜,可除去碳酸根离子和氢氧根离子,但铜元素属于重金属元素,会污染水体资源,故③不符合题意;
故选:①。
故答案为:(1)Na2CO3+CaCl2=CaCO3↓+2NaCl或Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(2)氢离子;氯化钡;有红褐色沉淀生成;
(3)碳酸钠溶液显碱性;
(4)①。
、无Ca2+,碳酸钠与氯化钡溶液反应有白色沉淀生成,则滴加足量某溶液是氯化钡溶液,继续滴加FeCl3溶液,实验结论是有氢氧根离子,氢氧根离子与铁离子结合生成红褐色沉淀,则实验现象是有红褐色沉淀生成;
(3)小明同学对方案提出质疑,他的理由是碳酸钠溶液显碱性,也能使酚酞试液变红色,因此不能确定溶液中是否含有氢氧根离子;
(4)滤液中含有碳酸根离子和氢氧根离子,
①向滤液中加入适量稀盐酸可以除去氢氧根离子和碳酸根离子,进行处理后再排放,故①符合题意;
②向滤液中加入适量的熟石灰,除去碳酸根离子同时有氢氧根离子生成,不能除去氢氧根离子,故②不符合题意;
③向滤液中加入适量硫酸铜,可除去碳酸根离子和氢氧根离子,但铜元素属于重金属元素,会污染水体资源,故③不符合题意;
故选:①。
故答案为:(1)Na2CO3+CaCl2=CaCO3↓+2NaCl或Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(2)氢离子;氯化钡;有红褐色沉淀生成;
(3)碳酸钠溶液显碱性;
(4)①。
[点评]
本题考查了"实验探究物质的组成成分以及含量,常见离子的检验方法及现象,",属于"易错题",熟悉题型是解题的关键。