[考点]
实验探究物质的组成成分以及含量,溶液的酸碱度测定,溶液的酸碱性与pH的关系,盐的化学性质,
[答案]
(1)引流;
(2)C;
(3)3;检验并完全除去碳酸钠;不能;
(4)有气泡产生,沉淀部分溶解;
(5)ACD。
[解析]
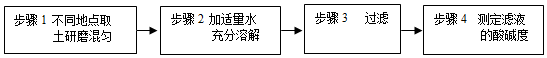
解:(1)步骤3是过滤操作,过滤操作中使用了玻璃棒,其作用是引流,防止液体溅出;故答案为:引流;
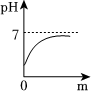
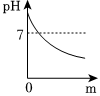
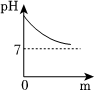
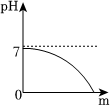
(2)经测定,滤液的pH为8>7,显碱性,随着淡水的不断加入,溶液的碱性减弱,pH减小,由大于7逐渐减小到接近7,由于溶液始终显碱性,则溶液的pH不能等于或小于7,能正确表示土壤中pH变化的图像的是C;故答案为:C;
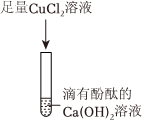
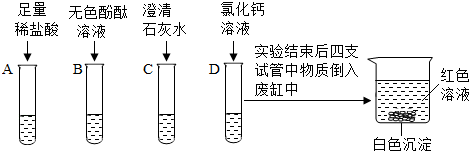
(3)无色酚酞遇碱性变红,碳酸钠溶液呈碱性,取滤液,滴加无色酚酞溶液,溶液变红,再滴加过量的BaCl2溶液,观察到生成白色沉淀,说明一定含有碳酸钠,碳酸钠与氯化钡反应生成白色沉淀碳酸钡和氯化钠,实验中加入过量的氯化钡可以检验并完全除去碳酸钠,防止对氢氧化钠的检验产生干扰,氯化钡除去碳酸钠后,观察到溶液仍为红色,说明还含有氢氧化钠,氢氧化钠显碱性,可使无色酚酞溶液变红色,综上说明浸出液中一定含有氢氧化钠和碳酸钠,则猜想3成立;
氯化钡溶液不能用氢氧化钡溶液代替,因为若用氢氧化钡溶液,引入了氢氧根离子,无法检验浸出液中是否含有氢氧化钠;故答案为:3;检验并完全除去碳酸钠;不能;
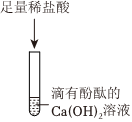
(4)根据实验结论土壤中还含有硫酸钠,硫酸钠和氯化钡反应生成硫酸钡沉淀和氯化钠,硫酸钡沉淀不溶于酸,碳酸钡沉淀能与稀盐酸反应生成氯化钡、二氧化碳和水,故将“探究二”中白色沉淀过滤出,滴加足量的稀盐酸,观察到有气泡产生,沉淀部分溶解,说明土壤中还含有硫酸钠;故答案为:有气泡产生,沉淀部分溶解;
(5)A、施加适量有机腐殖酸可以降低盐碱地的碱性,改良盐碱地,A合理;
B、熟石灰即氢氧化钙,氢氧化钙显碱性,可用于改良酸性土壤,但不能改良盐碱地,B不合理;
C、采用水灌排盐降碱,可以减小盐碱地中盐碱浓度,稀释土壤溶液,可用于改良盐碱地,C合理;
D、科学合理施肥,可减少对土壤的破坏,可用于改良盐碱地,D合理;
故选:ACD。
[点评]
本题考查了"实验探究物质的组成成分以及含量,溶液的酸碱度测定,溶液的酸碱性与pH的关系,盐的化学性质,",属于"综合题",熟悉题型是解题的关键。