[考点]
缺失标签的药品成分的探究,酸的化学性质,碱的化学性质,
[答案]
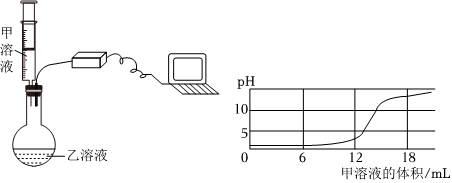
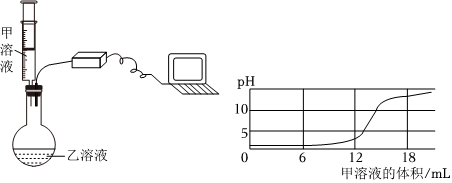
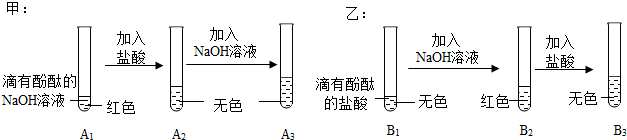
【设计实验】碱性。
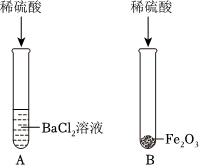
【获得结论】(1)H2SO4。
(2)D。
【讨论质疑】2NaOH+CO2═Na2CO3+H2O。
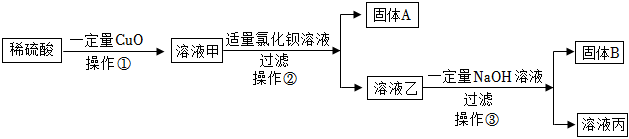
【实验与结论】BaCl2。
【拓展迁移】BC。
【拓展应用】AB。
[解析]
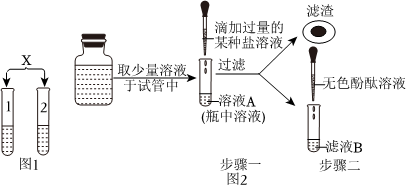
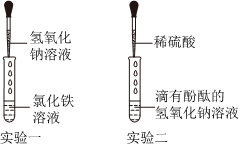
解:【设计实验】取未知溶液少量,滴入无色酚酞溶液,使酚酞溶液变红的是碱性溶液。
故答案为:碱性。
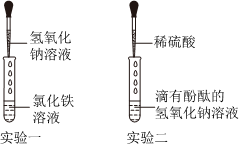
【获得结论】(1)氯化钡不能和稀盐酸反应,和稀硫酸反应生成硫酸钡沉淀和盐酸,因此1号试管溶液中的溶质是H2SO4。
故答案为:H2SO4。
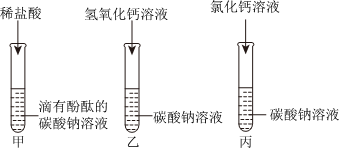
(2)以上四个实验方案中,只根据其中一个实验的现象即可证明2号试管中原溶液为氢氧化钠溶液,该方案是D,是因为碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,不能和氢氧化钠反应。
故答案为:D。
【讨论质疑】小强对方案B中2号试管产生白色沉淀现象提出质疑,经过实验探究获知2号试管中的原溶液已部分变质,即氢氧化钠和二氧化碳反应生成碳酸钠和水,化学方程式为2NaOH+CO2═Na2CO3+H2O。
故答案为:2NaOH+CO2═Na2CO3+H2O。
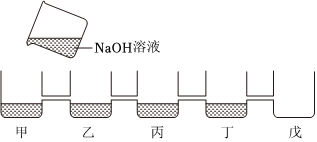
【实验与结论】步骤一中:向溶液A中滴加过量的BaCl2溶液,溶液中产生白色沉淀,是因为碳酸钠和氯化钡反应生成白色沉淀碳酸钡和氯化钠,得出这瓶氢氧化钠溶液已变质;
故答案为:BaCl2。
【拓展迁移】步骤二中能替代无色酚酞溶液也能达到实验目的的是氯化镁溶液(氯化镁和氢氧化钠反应生成白色沉淀氢氧化镁和氯化钠)、二氧化碳(二氧化碳和氢氧化钠反应生成碳酸钠和水,碳酸钠和过量的氯化钡反应生成白色沉淀碳酸钡和氯化钠)。
故答案为:BC。
【拓展应用】A.食醋清洗水瓶中的水垢(主要成分碳酸钙、氢氧化镁),过程中醋酸和氢氧化镁反应生成醋酸镁和水,和碳酸钙反应生成氯化钙、水和二氧化碳,都是复分解反应。
B.用熟石灰处理酸性废水,氢氧化钙和酸反应生成盐和水,是复分解反应。
C.古代的“湿法炼铜”:曾青得铁则化为铜,硫酸铜和铁反应生成硫酸亚铁和铜,是置换反应,不是复分解反应。
故答案为:AB。
[点评]
本题考查了"缺失标签的药品成分的探究,酸的化学性质,碱的化学性质,",属于"典型题",熟悉题型是解题的关键。