[考点]
金属活动性的探究,实验探究物质的组成成分以及含量,
[答案]
活动一:【猜想假设】Al>Cu>Mn;
【实验探究一】蓝色变为浅粉色;
【讨论交流】方案一;
活动二:2NaOH+H2SO4=Na2SO4+2H2O;
【实验探究二】产生白色沉淀;
【拓展迁移】Na2CO3。
[解析]
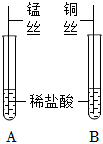
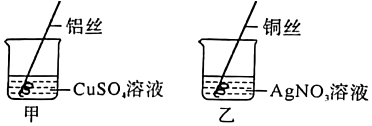
解:活动一:【猜想假设】比较金属Mn、Al、Cu的活动性,提出如下猜想:猜想1:Mn>Al>Cu,猜想3:Al>Mn>Cu,则 猜想2:Al>Cu>Mn;
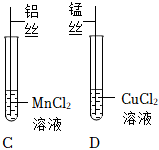
【实验探究一】锰是一种灰白色金属,氯化锰(MnCl2)溶液呈浅粉色,将铝丝伸入盛有MnCl2溶液的C试管中,铝丝与MnCl2溶液反应生成氯化铝和锰,则C试管中铝丝表面有固体析出,溶液由浅粉色变为无色,将锰丝伸入盛有CuCl2溶液的D试管中,锰丝与CuCl2溶液反应生成MnCl2和Cu,CuCl2溶液是蓝色的,则可观察到D试管中锰丝表面有红色固体析出,且溶液由蓝色变为浅粉色,说明金属的活动性顺序为Al>Mn>Cu;
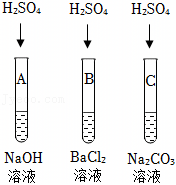
【讨论交流】方案一:只用一只盛有少量稀硫酸的试管,依次插入Mn、Cu、Al,插入锰时,锰与稀硫酸反应生成硫酸锰和氢气,再插入铜丝时,铜不与硫酸锰反应,则锰的金属活动性大于铜,继续插入铝丝时,铝与硫酸锰反应生成锰和硫酸铝,则铝的金属活动性大于锰,则金属的活动性顺序为Al>Mn>Cu,故方案一设计正确;
方案二:只用一只盛有少量稀硫酸的试管,依次插入Al、Mn、Cu,插入铝时,铝与稀硫酸反应生成硫酸铝和氢气,再插入锰丝时,锰不与硫酸铝反应,则铝的活动性大于锰,继续插入铜丝时,铜不与硫酸铝反应,则铝的活动性大于铜,无法比较锰和铜的活动性大小,故方案二设计错误;
故选:方案一。
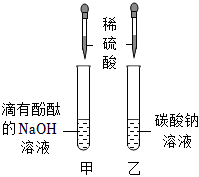
活动二:甲试管中的氢氧化钠溶液与加入的稀硫酸反应生成硫酸钠和水,反应的化学方程式为2NaOH+H2SO4=Na2SO4+2H2O;
【实验探究二】实验结论是废液中含有Na2SO4和NaOH,则取少量废液于试管中,加入过量的硝酸钡溶液,硫酸钠与硝酸钡溶液反应生成白色沉淀硫酸钡和硝酸钠,溶液中有氢氧化钠,显碱性,溶液仍为红色,故观察到的现象是产生白色沉淀,溶液仍为红色;
【拓展迁移】若实验3中观察到的现象不变,实验4的现象为“白色沉淀部分溶解并产生气泡,溶液呈无色,说明白色沉淀是硫酸钡和碳酸钡的混合物,碳酸钡能与稀硝酸反应生成硝酸钡、二氧化碳和水,则原废液中含有的溶质为Na2SO4、NaOH和Na2CO3。
故答案为:活动一:【猜想假设】Al>Cu>Mn;
【实验探究一】蓝色变为浅粉色;
【讨论交流】方案一;
活动二:2NaOH+H2SO4=Na2SO4+2H2O;
【实验探究二】产生白色沉淀;
【拓展迁移】Na2CO3。
[点评]
本题考查了"金属活动性的探究,实验探究物质的组成成分以及含量,",属于"易错题",熟悉题型是解题的关键。
 ?
?
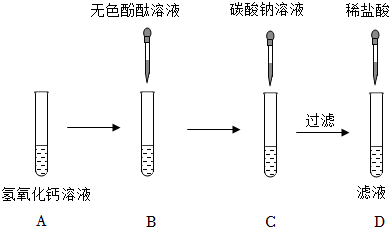
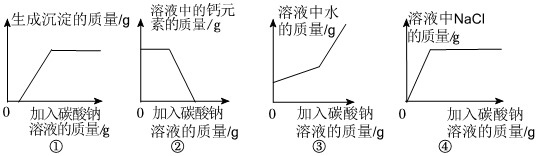
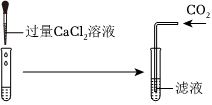 兴趣小组同学自制呼吸面具,准备用过氧化钠(Na2O2)作为供氧剂,但在实验室找到了一瓶敞口放置的过氧化钠。
兴趣小组同学自制呼吸面具,准备用过氧化钠(Na2O2)作为供氧剂,但在实验室找到了一瓶敞口放置的过氧化钠。