[考点]
实验探究物质的组成成分以及含量,碱的化学性质,盐的化学性质,
[答案]
(1)能;
(2)二、四;
(3)溶液过一段时间变红;
(4)CaCl2+Na2CO3=CaCO3↓+2NaCl;
(5)溶液C中一定含碳酸钠和氢氧化钙反应生成的氢氧化钠,氢氧化钠显碱性,能使无色酚酞试液变红,而实验结束后,D中溶液为无色,说明氢氧化钠和盐酸反应生成了氯化钠和水,D中一定含氯化钠;
(6)③④。
[解析]
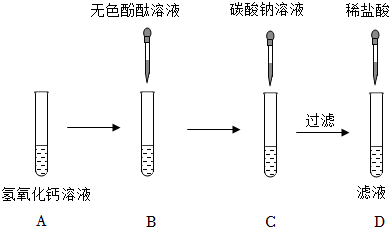
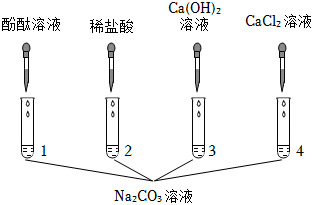
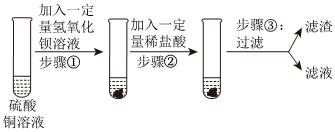
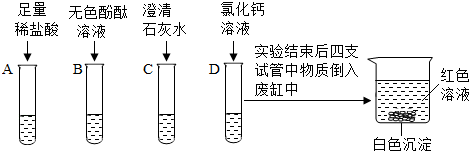
解:(1)向B中加入无色酚酞试液,然后加入碳酸钠溶液,碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,故反应后C中一定含氢氧化钠,氢氧化钠溶液显碱性,能使无色酚酞试液变红,滴入稀盐酸,实验结束后,D中溶液为无色,说明反应后氢氧化钠消失,说明氢氧化钠和稀盐酸发生了反应,故能说明碱可以与酸发生反应;
(2)反应后,D中溶液为无色,而无色酚酞试液遇到碱性溶液变红,故D中溶液一定不含碱性物质,一定不含氢氧化钠、碳酸钠,故根据实验现象,猜想二、四不成立;
(3)结论为猜想一成立,则D中溶液含HCl,取适量D中溶液于试管中,逐滴加入氢氧化钠溶液至过量,氢氧化钠能与稀盐酸反应生成氯化钠和水,氯化钠显中性、稀盐酸显酸性,不能使无色酚酞试液变色,待盐酸完全反应,氢氧化钠过量时,溶液显碱性,能使无色酚酞试液变红,故观察到试管中溶液过一段时间变红,说明猜想一成立;
(4)继续向所得溶液中通入CO2,二氧化碳与氢氧化钠反应生成碳酸钠和水,氯化钙能与碳酸钠反应生成碳酸钙和氯化钠,故产生白色沉淀的化学方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl;
(5)碳酸钠和氢氧化钙一定反应生成了氢氧化钠,氢氧化钠溶液显碱性,能使无色酚酞试液变红,实验结束后,D中溶液为无色,说明氢氧化钠和稀盐酸发生反应生成了氯化钠,则D中一定含氯化钠,故剩余猜想肯定成立;
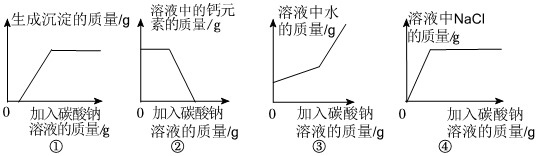
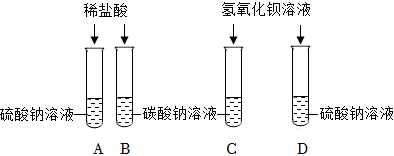
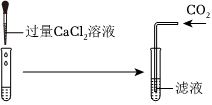
(6)①由以上分析可知,D中溶液中含氯化钠、氯化氢、氯化钙,取适量D中溶液于试管中,逐滴加入碳酸钠溶液至过量,碳酸钠先与盐酸反应生成氯化钠、二氧化碳和水,待盐酸完全反应后,碳酸钠和氯化钙反应生成碳酸钙和氯化钠,故一开始无沉淀生成,后生成沉淀的质量逐渐增大,待完全反应后,不再变化,不符合题意;
②取适量D中溶液于试管中,逐滴加入碳酸钠溶液至过量,碳酸钠先与盐酸反应生成氯化钠、二氧化碳和水,待盐酸完全反应后,碳酸钠和氯化钙反应生成碳酸钙和氯化钠,故溶液中钙元素的质量一开始不变,后逐渐减小至零,不符合题意;
③取适量D中溶液于试管中,逐滴加入碳酸钠溶液至过量,碳酸钠先与盐酸反应生成氯化钠、二氧化碳和水,此时溶液中水的增加量为反应生成水的质量加上碳酸钠中本身含有水的质量,待盐酸完全反应后,碳酸钠和氯化钙反应生成碳酸钙和氯化钠,此时水的增加量等于碳酸钠中本身含有水的质量,故随着碳酸钠溶液的不断加入,溶液中水的质量不断增加,待盐酸完全反应后,继续滴加碳酸钠溶液,水的质量继续增加,但是增加幅度变小,符合题意;
④取适量D中溶液于试管中,逐滴加入碳酸钠溶液至过量,碳酸钠先与盐酸反应生成氯化钠、二氧化碳和水,待盐酸完全反应后,碳酸钠和氯化钙反应生成碳酸钙和氯化钠,故溶液中氯化钠的质量不断增加,待完全反应后,不再变化,但是不是从零开始逐渐增加,符合题意。
故答案为:(1)能;
(2)二、四;
(3)溶液过一段时间变红;
(4)CaCl2+Na2CO3=CaCO3↓+2NaCl;
(5)溶液C中一定含碳酸钠和氢氧化钙反应生成的氢氧化钠,氢氧化钠显碱性,能使无色酚酞试液变红,而实验结束后,D中溶液为无色,说明氢氧化钠和盐酸反应生成了氯化钠和水,D中一定含氯化钠;
(6)③④。
[点评]
本题考查了"实验探究物质的组成成分以及含量,碱的化学性质,盐的化学性质,",属于"典型题",熟悉题型是解题的关键。
 ?
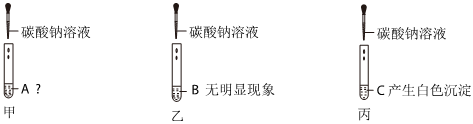
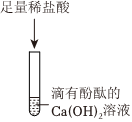
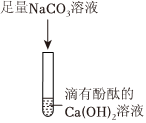
?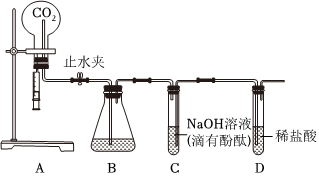 无明显现象实验的可视化研究是实验探究的重要内容。某兴趣小组同学在老师的指导下借助下列装置探究无明显现象的反应:
无明显现象实验的可视化研究是实验探究的重要内容。某兴趣小组同学在老师的指导下借助下列装置探究无明显现象的反应:
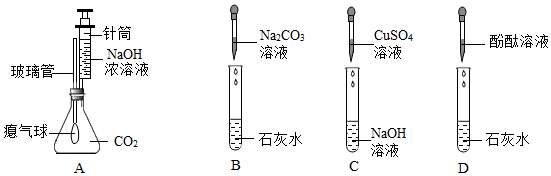
 兴趣小组同学自制呼吸面具,准备用过氧化钠(Na2O2)作为供氧剂,但在实验室找到了一瓶敞口放置的过氧化钠。
兴趣小组同学自制呼吸面具,准备用过氧化钠(Na2O2)作为供氧剂,但在实验室找到了一瓶敞口放置的过氧化钠。