[考点]
实验探究物质的组成成分以及含量,盐酸的物理性质,酸的化学性质,盐的化学性质,
[答案]
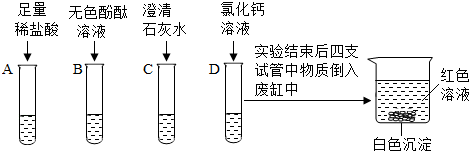
任务一:
挥发。
任务二:
(1)溶液由无色变成浅绿色。
(2)Ba(OH)2+2HCl=BaCl2+2H2O。
任务三:
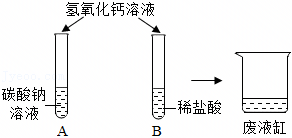
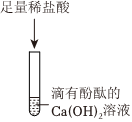
【交流讨论】最终烧杯中溶液呈无色,说明溶液不显碱性,而碳酸钠溶液显碱性,因此溶液中不含有碳酸钠。
【实验验证】产生白色沉淀。
任务四:
除锈。
[解析]
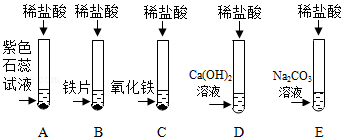
解:任务一:
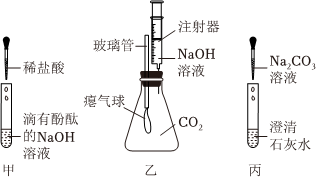
打开盛有浓盐酸的试剂瓶盖,观察到瓶口有白雾,形成这种现象的原因是浓盐酸具有挥发性,挥发出的氯化氢气体在瓶口处与空气中的水蒸气结合生成盐酸小液滴。
故答案为:挥发。
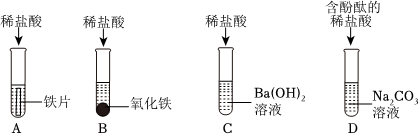
任务二:
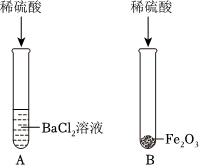
(1)A中铁和稀盐酸反应生成氯化亚铁和氢气,氯化亚铁溶液是浅绿色溶液,可观察到的现象是铁片逐渐溶解,表面有气泡冒出,溶液由无色变成浅绿色。
故答案为:溶液由无色变成浅绿色。
(2)C中氢氧化钡和稀盐酸反应生成氯化钡和水,发生反应的化学方程式为Ba(OH)2+2HCl=BaCl2+2H2O。
故答案为:Ba(OH)2+2HCl=BaCl2+2H2O。
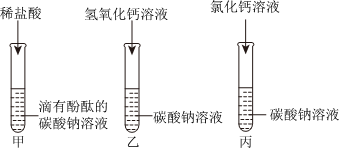
任务三:
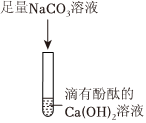
实验结束后,同学们将C、D试管中的所有物质倒入一只洁净的大烧杯中,观察到先有气泡产生,说明C中稀盐酸过量,与D中过量的碳酸钠反应生成氯化钠、水和二氧化碳,后有白色沉淀生成,说明稀盐酸完全反应后,过量的碳酸钠和氯化钡反应生成白色沉淀碳酸钡和氯化钠,静置一段时间后,最终烧杯中溶液呈无色,说明碳酸钠完全反应。
【交流讨论】经过讨论,同学们一致认为猜想三是错误的,理由是最终烧杯中溶液呈无色,说明溶液不显碱性,而碳酸钠溶液显碱性,因此溶液中不含有碳酸钠。
故答案为:最终烧杯中溶液呈无色,说明溶液不显碱性,而碳酸钠溶液显碱性,因此溶液中不含有碳酸钠。
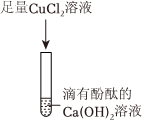
【实验验证】取少量烧杯中上层清液于试管中,滴加适量的硫酸钠溶液,观察到产生白色沉淀,是因为过量的氯化钡和硫酸钠反应生成白色沉淀硫酸钡和氯化钠,说明猜想二成立。
故答案为:产生白色沉淀。
任务四:
根据任务二中试管B中的反应,即稀盐酸能和铁锈中的主要成分氧化铁反应生成氯化铁和水,说明盐酸在工业中的可以用来除锈。
故答案为:除锈。
[点评]
本题考查了"实验探究物质的组成成分以及含量,盐酸的物理性质,酸的化学性质,盐的化学性质,",属于"综合题",熟悉题型是解题的关键。