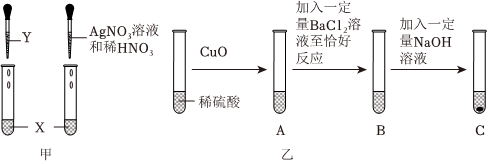
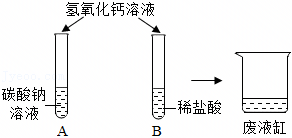
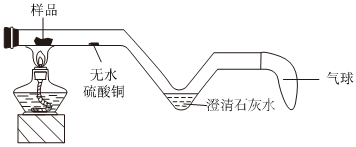
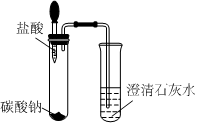
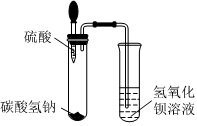
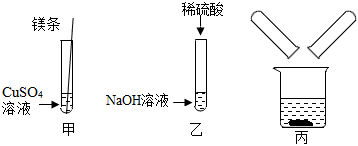
[考点]
实验探究物质的性质或变化规律,实验探究物质的组成成分以及含量,酸的化学性质,盐的化学性质,
[答案]
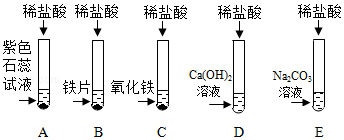
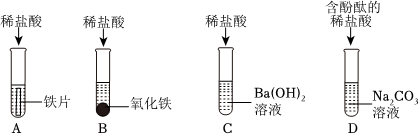
(1)C;
(2)HCl+NaOH=NaCl+H2O;
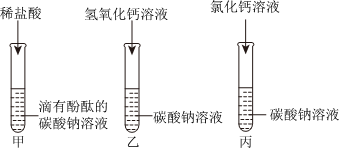
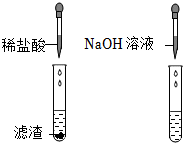
(3)【猜想与假设】氯化钠和氯化钙;
【分析讨论】二、三;
【实验验证】白色沉淀;钠离子、钙离子、氯离子和水分子。
[解析]
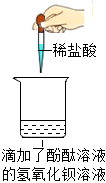
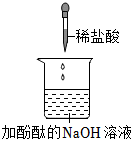
解:(1)上述实验中需要借助酸碱指示剂来判断发生了化学反应的试管是C,这是因为稀盐酸和氢氧化钠反应生成氯化钠和水的过程中无明显现象;故答案为:
(2)试管C中是氢氧化钠和稀盐酸反应生成氯化钠和水,反应的化学方程式为:HCl+NaOH=NaCl+H2O;故答案为:HCl+NaOH=NaCl+H2O;
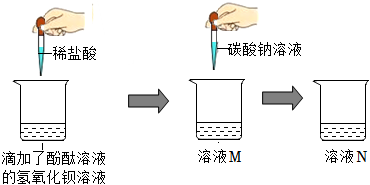
(3)【猜想与假设】把试管中的废液倒入同一个干净的烧杯中,静置后观察到无色溶液和白色沉淀,说明不含氢氧化钙,氢氧化钠和碳酸钠,因为酚酞在碱性条件下会变红,能生成白色沉淀,说明不含盐酸,故猜想一:只含有氯化钠;猜想二:氯化钠和氯化氢;猜想三:氯化钠和碳酸钠;另一种猜想是:氯化钠和氯化钙;故答案为:氯化钠和氯化钙;
【分析讨论】通过同学们认真分析和讨论可知,如果含有盐酸,则不能产生沉淀,如果含有碳酸钠,则溶液显红色,因此上述猜想中的猜想二、猜想三不正确;故答案为:二、三;
【实验验证】取少量滤液于试管中,滴加少量碳酸钠溶液,观察到产生白色沉淀,是因为碳酸钠和氯化钙反应生成了碳酸钙沉淀,则另一种猜想正确,即含有氯化钠和氯化钙,所以滤液中所含的微粒是:钠离子、钙离子、氯离子和水分子;故答案为:白色沉淀;钠离子、钙离子、氯离子和水分子。
[点评]
本题考查了"实验探究物质的性质或变化规律,实验探究物质的组成成分以及含量,酸的化学性质,盐的化学性质,",属于"综合题",熟悉题型是解题的关键。
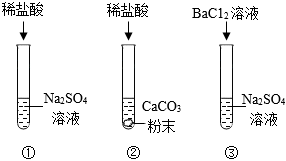
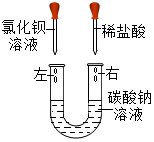 某化学活动小组在一次实验中进行如图所示实验:
某化学活动小组在一次实验中进行如图所示实验: