[考点]
实验探究物质的组成成分以及含量,碱的化学性质,反应类型的判定,
[答案]
【探究1】①③;
【提出猜想】反应物中无氢元素;
【得出结论】四;
【表达交流】(1)BaCl2+Na2CO3=BaCO3↓+2NaCl;
(2)B;
(3)除尽碳酸钠,防止对步骤③鉴别的干扰;
(4)BCD。
[解析]
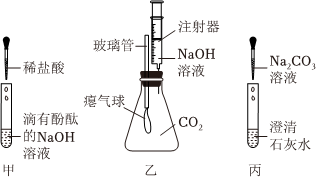
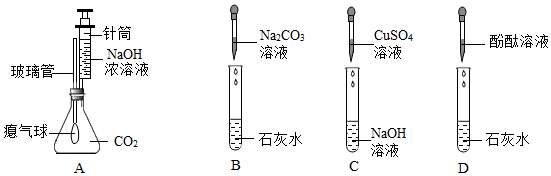
解:【探究1】①金属镁在O2、N2、CO2中均能燃烧,所以燃烧不一定有氧气参加,此选项正确;
②反应前后氧元素的化合价不变,此选项错误;
③不是所有的火灾都能用CO2来灭火,镁着火不能用CO2灭火,此选项正确;
④因为碳不能与稀盐酸反应,而氧化镁能与稀盐酸反应,所以向反应后所得固体中加入足量稀盐酸,观察到固体部分溶解,无气泡产生,此选项错误;
故选①③。
【提出猜想】同学们通过理论分析认为猜想二肯定是错误的,其依据是反应物中无氢元素,不可能生成氢氧化钠。
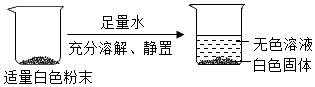
①取反应后的生成物少许于试管中,加入足量的水,固体部分溶解,试管底部有黑色固体,说明固体中含有C;
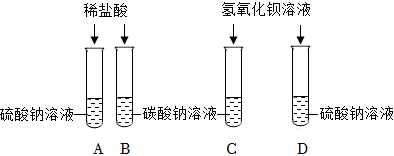
②取少量步骤①所得上层溶液,加入过量的BaCl2溶液,产生白色沉淀,说明固体中含有Na2CO3;
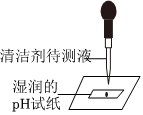
③取少量步骤②所得上层清液,滴到湿润的pH试纸上,测得pH=10,显碱性,因为Na2O能与H2O反应生成NaOH,则说明固体中含有Na2O。
【得出结论】由上述分析可知,猜想四是正确的。
【表达交流】(1)步骤②中发生的反应是氯化钡和碳酸钠生成碳酸钡沉淀和氯化钠,化学方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl。
(2)测定溶液的pH,不能用水润湿pH试纸,步骤③中将步骤②所得上层清液,滴到湿润的pH试纸上,测得pH=10,则步骤②所得上层清液的pH>10,故选B。
(3)在步骤②中加入过量BaCl2溶液的目的是除尽碳酸钠,防止对步骤③氢氧化钠的检验造成干扰。
(4)A.二氧化碳与氢氧化钠溶液反应无明显现象,此选项不符合题意;
B.氯化铵溶液与氢氧化钠溶液反应能生成有刺激性气味的气体,可说明NaOH存在,进而说明是Na2O与H2O反应生成了NaOH,此选项符合题意;
C.硫酸镁溶液与氢氧化钠溶液反应产生白色沉淀,可说明NaOH存在,进而说明是Na2O与H2O反应生成了NaOH,此选项符合题意;
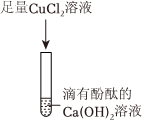
D.氯化铜溶液与氢氧化钠溶液反应产生蓝色沉淀,可说明NaOH存在,进而说明是Na2O与H2O反应生成了NaOH,是此选项符合题意;
故选BCD。
故答案为:【探究1】①③;
【提出猜想】反应物中无氢元素;
【得出结论】四;
【表达交流】(1)BaCl2+Na2CO3=BaCO3↓+2NaCl;
(2)B;
(3)除尽碳酸钠,防止对步骤③鉴别的干扰;
(4)BCD。
[点评]
本题考查了"实验探究物质的组成成分以及含量,碱的化学性质,反应类型的判定,",属于"典型题",熟悉题型是解题的关键。