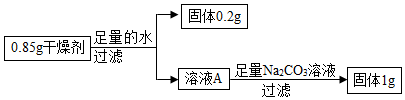
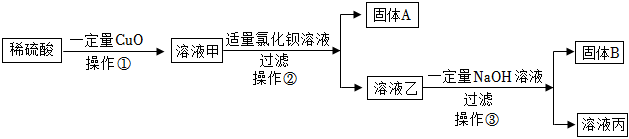
[考点]
实验探究物质的组成成分以及含量,碱的化学性质,盐的化学性质,
[答案]
(1)反应物被消耗(或溶液中某些离子浓度发生变化);乙;
(2)BaCl2+Na2CO3═BaCO3↓+2NaCl;NaCl、Ba(OH)2;继续滴加酚酞溶液,溶液仍为红色;pH试纸。
[解析]
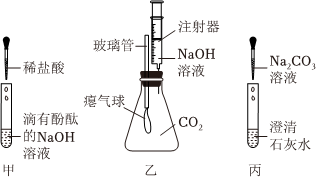
解:(1)两位同学的探究思路均是从反应物被消耗(或溶液中某些离子浓度发生变化)的角度证明反应发生了。甲同学的实验中,二氧化碳能溶于水且能与水反应,也会使试管内液面上升,所以甲同学的探究方法不严谨;乙同学通过酚酞颜色的变化,能证明氢氧化钡溶液与稀盐酸发生了反应,所以乙同学的探究方法及结论是正确的。
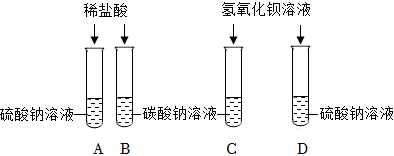
(2)装置A中二氧化碳与氢氧化钠反应生成碳酸钠和水,装置B中氢氧化钡与盐酸反应生成氯化钡和水,将反应后A、B中的溶液混合,产生白色沉淀,是碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,化学方程式为:BaCl2+Na2CO3═BaCO3↓+2NaCl。
【做出猜想】反应后溶液呈红色,说明溶液显碱性,除了生成的氯化钠外,还可能含有氢氧化钠,碳酸钠与氯化钡反应时,碳酸钠过量,所以溶液中的溶质还可能是NaCl、Na2CO3、NaOH;也可能是氯化钡过量,此时溶液中的溶质为NaCl、BaCl2、NaOH;还可能是碳酸钠与氯化钡恰好完全反应,此时溶液中的溶质为NaCl、NaOH。另外一种可能是碳酸钠和氯化钡恰好完全反应,但是氢氧化钡有剩余,所以你的猜想可以是:NaCl、Ba(OH)2。
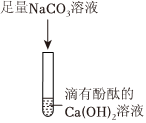
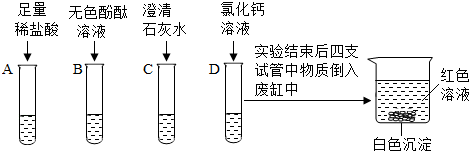
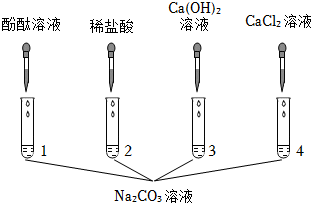
【验证猜想】取少量上层红色清液于试管中,加入过量的Ba(NO3)2溶液,观察到产生白色沉淀,说明溶液中含有碳酸钠,继续滴加酚酞溶液,溶液仍为红色,说明溶液中含有氢氧化钠,则丙同学的猜想正确。
【反思评价】丁同学认为可将乙同学得到的B装置中的无色溶液蒸发结晶,再将得到的固体溶于水,室温下用pH试纸测得溶液呈中性,说明反应后溶液中不存在氢氧化钡,从而从有新物质生成的角度验证反应的发生。
故答案为:(1)反应物被消耗(或溶液中某些离子浓度发生变化);乙;
(2)BaCl2+Na2CO3═BaCO3↓+2NaCl;NaCl、Ba(OH)2;继续滴加酚酞溶液,溶液仍为红色;pH试纸。
[点评]
本题考查了"实验探究物质的组成成分以及含量,碱的化学性质,盐的化学性质,",属于"难典题",熟悉题型是解题的关键。
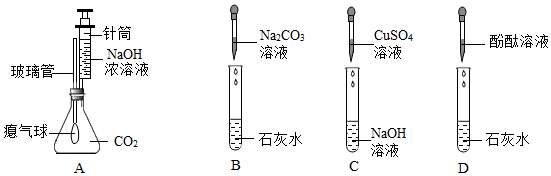
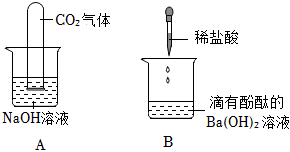 实验课上,某化学小组探究两个初中常见的无明显现象的反应:甲同学利用装置A将装满CO2的试管倒扣在盛有NaOH溶液的烧杯中,乙同学借助无色酚酞溶液利用装置B进行中和反应,如图所示:
实验课上,某化学小组探究两个初中常见的无明显现象的反应:甲同学利用装置A将装满CO2的试管倒扣在盛有NaOH溶液的烧杯中,乙同学借助无色酚酞溶液利用装置B进行中和反应,如图所示: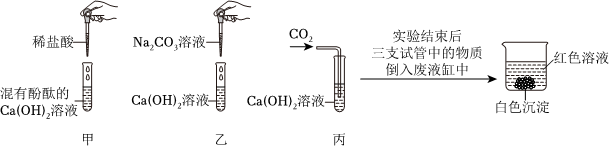
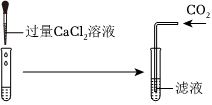 兴趣小组同学自制呼吸面具,准备用过氧化钠(Na2O2)作为供氧剂,但在实验室找到了一瓶敞口放置的过氧化钠。
兴趣小组同学自制呼吸面具,准备用过氧化钠(Na2O2)作为供氧剂,但在实验室找到了一瓶敞口放置的过氧化钠。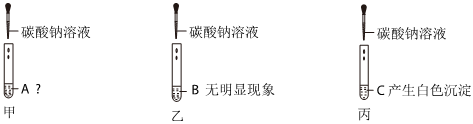
 ?
?