服务热线
搜题▪组卷
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量步骤Ⅲ后所得溶液于试管中,加入足量BaCl2溶液 | 猜想②成立 |
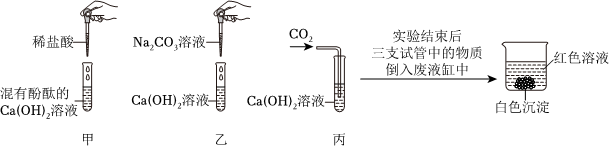
| 实验方案 | 实验现象 | 实验结论 | |
| 甲同学 | 取少量废液缸中上层红色溶液于试管中,加入过量CaCl2溶液。 | 观察到 。 | 猜想三成立。 |
| 乙同学 | 取少量废液缸中上层红色溶液于试管中,加入Ca(OH)2溶液。 | 与甲同学相同的现象。 | 猜想三成立。 |
| 实验操作 | 实验现象 | 实验结论 | |
| 取少量烧杯内的上层清液于试管中 | ①向试管中加入过量BaCl2溶液 | 产生白色沉淀 | 清液中一定还含有Na2CO3和NaOH。 |
| ②将①所得物质过滤,得到滤渣和滤液,取滤液于试管中,加入无色酚酞溶液 | 溶液变红色 | ||
| ③取滤渣于试管中,加入过量稀硝酸 | |||
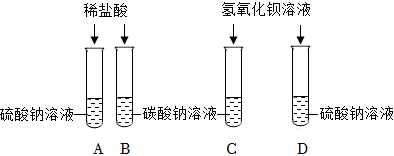
| 实验一 | 实验现象 | 实验结论 |
| 分别用a、b、c三支试管取样,各加入2 mL碳酸钠溶液 | a中 | a中物质是稀盐酸 |
| b中无明显现象 | b中物质是食盐水 | |
| c中产生白色沉淀 | c中物质是 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取一定量滤液于试管中,加入一种盐溶液(写溶质化学式) | 有白色沉淀 | 猜想一正确 |
| 用pH试纸测定a试管反应后废液酸碱性的过程 | 测定结果 |
| 在白瓷板上方一小片pH试纸,用 蘸取待测溶液涂抹在试纸上,片刻后与标准比色卡对照,读出pH数值 | pH<7 |
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量丙中上层清液于试管中,滴加BaCl2溶液 | 猜想二不成立 | |
| ②另取少量丙中上层清液于试管中,滴加K2CO3溶液 | 有白色沉淀产生 | 猜想 成立 |
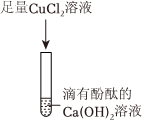
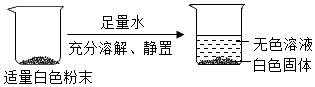
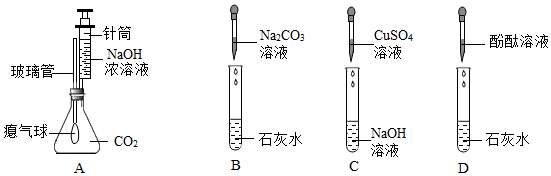
| 实验操作 | 实验现象 | 实验结论 |
| 步骤1:取少量废液于试管中,加入过量的氯化钙溶液 | ① 。 | 废液中有K2CO3 |
| 步骤2:取少量步骤1所得的上层清液,向其中加入硫酸铜溶液 | 有蓝色絮状沉淀产生 | ②废液中有 。 |
| 实验步骤 | 现象 | 实验结论 | |
| 取过滤后的溶液各少许,分别装在2支试管里 | ①向第一支试管中滴加少量稀盐酸 | 无明显现象 | 猜想Ⅱ错误 |
| ②向第二支试管液中加入Na2CO3 | 猜想Ⅲ正确 | ||
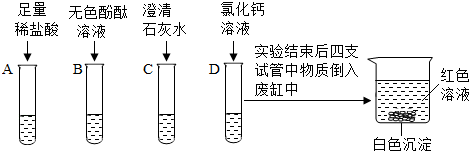
| 实验方案 | 实验现象 | 实验结论 | |
| 小田同学 | 取少量废液缸中上层红色溶液于试管中,加入过量的BaCl2溶液 | 观察到 | 猜想二成立 |
| 小威同学 | 取少量废液缸中上层红色溶液于试管中,加入过量的Ba(OH)2溶液 |
| 实验操作 | 实验现象 | 结论 |
| 在试管甲中滴加碳酸钠溶液 | 未产生白色沉淀 | 猜想 错误 |
| 在试管乙中滴加足量的稀盐酸 | 猜想二正确 |
 兴趣小组同学自制呼吸面具,准备用过氧化钠(Na2O2)作为供氧剂,但在实验室找到了一瓶敞口放置的过氧化钠。
兴趣小组同学自制呼吸面具,准备用过氧化钠(Na2O2)作为供氧剂,但在实验室找到了一瓶敞口放置的过氧化钠。| 实验编号 | 实验操作 | 实验现象 | 实验结论 |
| 甲 | 向试管1中滴加足量稀盐酸 | 有气泡产生 | 猜想 不正确 |
| 乙 | 向试管2中滴加Ca(OH)2溶液至不再有白色沉淀生成,向上层清液中滴加几滴无色酚酞试液 | 溶液变红 | 猜想三正确 |
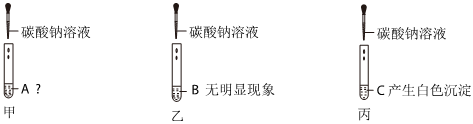
| 实验操作 | 实验现象 | 实验结论 |
| 取少量滤液于试管中,加入过量稀盐酸 | 无明显现象 | 猜想 正确 |
| 另取少量滤液于试管中,加入过量Na2CO3溶液 |
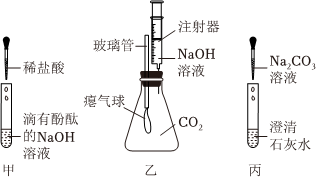
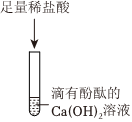
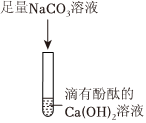
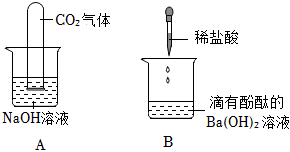 实验课上,某化学小组探究两个初中常见的无明显现象的反应:甲同学利用装置A将装满CO2的试管倒扣在盛有NaOH溶液的烧杯中,乙同学借助无色酚酞溶液利用装置B进行中和反应,如图所示:
实验课上,某化学小组探究两个初中常见的无明显现象的反应:甲同学利用装置A将装满CO2的试管倒扣在盛有NaOH溶液的烧杯中,乙同学借助无色酚酞溶液利用装置B进行中和反应,如图所示: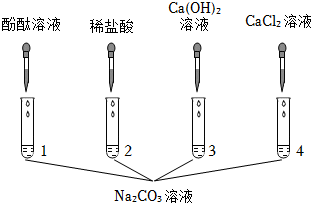 ?
?| 实验步骤 | 实验现象 | 结论 |
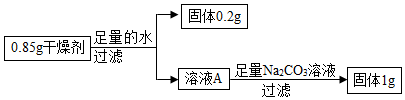
| Ⅰ.取少量干燥剂于试管中,向试管中加入少量的水,用手触摸试管外壁 | 试管外壁有热感 | 含有 CaO |
| Ⅱ.向步骤Ⅰ加水后的试管中滴入无色酚酞溶液 | 溶液变红色 | 含有Ca(OH)2 |
| Ⅲ.向进行完步骤Ⅱ的试管中加入足量的稀盐酸 | 溶液由红色变成无色,产生气泡 | 含有CaCO3 |
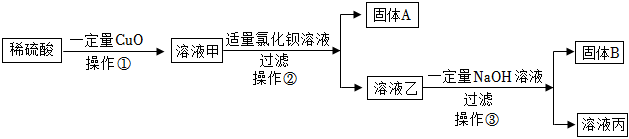
| 实验方案 | 实验现象 | 实验结论 |
| 方案一:取适量溶液丙于试管内,向其中滴加硫酸铵溶液,管口放置湿润的红色石蕊试纸,微热。 | 试纸变 色。 | 猜想二成立。 |
| 方案二:用玻璃棒蘸取适量溶液丙,滴于湿润的pH试纸上,待显色后与标准比色卡对照读数。 | pH=12。 |

dchx2021
2021-07-26
初中化学 | | 实验探究题