[考点]
实验探究物质的组成成分以及含量,物质的性质决定的存放方式,生石灰的性质与用途,碱的化学性质,盐的化学性质,
[答案]
(1)步骤①:放热;
步骤②:Na2CO3;
步骤③:固体溶解,产生气泡;
(2)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
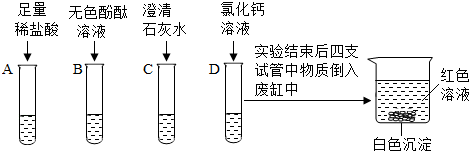
(3)ACD;
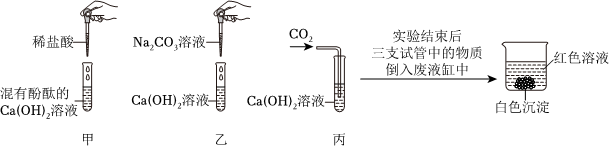
(4)丙;
(5)A。
[解析]
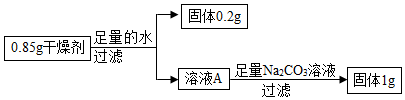
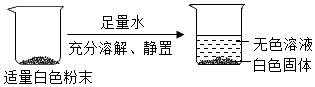
解:(1)步骤①:实验结论是该碱石灰中含CaO与NaOH中至少一种,氧化钙和水反应放热,氢氧化钠溶于水放热,则固体部分溶解,且放热;
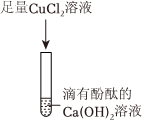
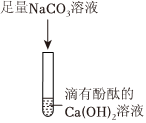
步骤②:碳酸钠和氯化钡反应生成氯化钠和白色沉淀碳酸钡,加氯化钡有白色沉淀,结合猜想中的物质可知,碱石灰中一定含有Na2CO3;
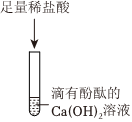
步骤③:结论是碱石灰中有碳酸钙,在碳酸钙中加入盐酸生成二氧化碳、氯化钙和水,则现象为固体溶解,产生气泡;
(2)根据上述步骤①、步骤②可知,该碱石灰中含有碳酸钠、氧化钙或者氢氧化钠,步骤③是步骤①加水过滤后的固体,步骤①加水可能会发生氧化钙和水反应生成氢氧化钙,而氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,不能确定原混合物中是否有碳酸钙,故有同学认为步骤③得出的实验结论不准确,原因是Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(3)A、浓盐酸具有挥发性,需密封保存,故A符合题意;
B、氯化钠性质稳定,不需要密封保存,故B不符合题意;
C、浓硫酸具有吸水性,故需要密封保存,故C符合题意;
D、铁粉能吸收空气中的氧气和水蒸气,需要密封保存,胡D符合题意;
故选:ACD;
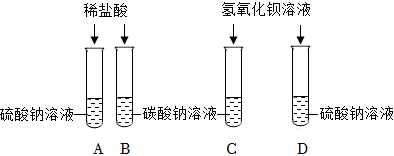
(4)除杂只能和杂质反应,不能和主要物质反应,不能生成新杂质;
甲:通入的二氧化碳和碳酸钠、氢氧化钠都反应,故甲不符合题意;
乙:滴加的适量稀盐酸和碳酸钠、氢氧化钠都反应,故乙不符合题意;
丙:滴加适量氢氧化钡溶液,氢氧化钡和碳酸钠反应生成碳酸钡沉淀和氢氧化钠,过滤后能除去碳酸钡,适量的氢氧化钡不会引入新杂质,故丙符合题意;
丁:滴加过量氢氧化钙溶液,氢氧化钙能和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,过滤后能除去碳酸钠,但过量的氢氧化钙会引入新杂质,故丁不符合题意;
故选:丙;
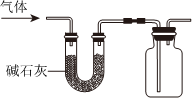
(5)碱石灰能干燥碱性气体和中性气体,不能干燥酸性气体,气体是从长管通入,空气从短管排出,说明收集到的气体密度比空气大;
A、氧气是中性气体,密度大于空气,故A符合题意;
B、二氧化碳是酸性气体,故B不符合题意;
C、氢气是中性气体,但密度小于空气,故C不符合题意;
D、氨气是碱性气体,但密度小于空气,故D不符合题意;
故选:A。
故答案为:(1)步骤①:放热;
步骤②:Na2CO3;
步骤③:固体溶解,产生气泡;
(2)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(3)ACD;
(4)丙;
(5)A。
[点评]
本题考查了"实验探究物质的组成成分以及含量,物质的性质决定的存放方式,生石灰的性质与用途,碱的化学性质,盐的化学性质,",属于"压轴题",熟悉题型是解题的关键。
 兴趣小组同学自制呼吸面具,准备用过氧化钠(Na2O2)作为供氧剂,但在实验室找到了一瓶敞口放置的过氧化钠。
兴趣小组同学自制呼吸面具,准备用过氧化钠(Na2O2)作为供氧剂,但在实验室找到了一瓶敞口放置的过氧化钠。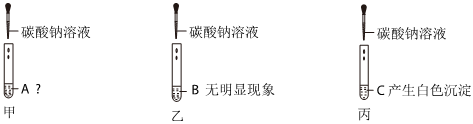
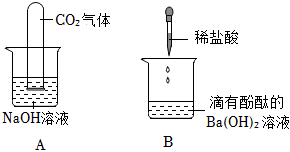 实验课上,某化学小组探究两个初中常见的无明显现象的反应:甲同学利用装置A将装满CO2的试管倒扣在盛有NaOH溶液的烧杯中,乙同学借助无色酚酞溶液利用装置B进行中和反应,如图所示:
实验课上,某化学小组探究两个初中常见的无明显现象的反应:甲同学利用装置A将装满CO2的试管倒扣在盛有NaOH溶液的烧杯中,乙同学借助无色酚酞溶液利用装置B进行中和反应,如图所示: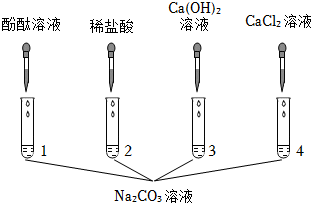 ?
?