[考点]
实验探究物质的组成成分以及含量,酸的化学性质,
[答案]
【猜想与假设】
NaCl和HCl。
【讨论与交流】
Na2CO3+2HCl═2NaCl+H2O+CO2↑。
【实验与结论】
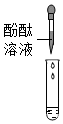
(1)错误;废液中的溶质是NaCl时,加入酚酞溶液也无明显现象。
(2)BC。
[解析]
解:【猜想与假设】
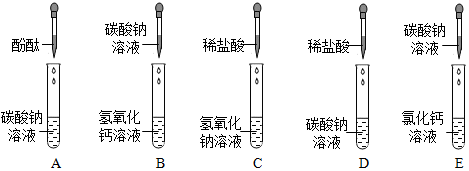
猜想1:废液中的溶质是NaCl、Na2CO3和HCl;
猜想2:恰好完全反应时废液中的溶质是NaCl;
猜想3:盐酸过量时废液中的溶质是NaCl和HCl;
猜想4:碳酸钠过量时废液中的溶质是Na2CO3和NaCl。
故答案为:NaCl和HCl。
【讨论与交流】
小明认为猜想1无需验证就知道是错误的,他的理由是碳酸钠和稀盐酸不能共存,即碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式:Na2CO3+2HCl═2NaCl+H2O+CO2↑。
故答案为:Na2CO3+2HCl═2NaCl+H2O+CO2↑。
【实验与结论】
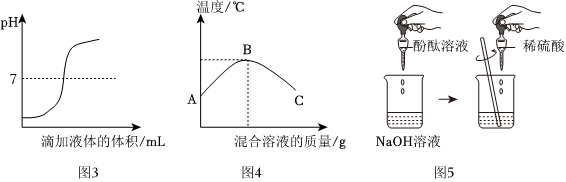
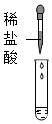
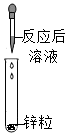
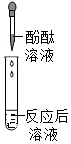
(1)小鹏同学为验证猜想3,取少量废液于试管中,然后滴入酚酞溶液,发现溶液不变色,于是小亮认为猜想3正确。他的结论错误,理由是废液中的溶质是NaCl时,加入酚酞溶液也无明显现象。
故答案为:错误;废液中的溶质是NaCl时,加入酚酞溶液也无明显现象。
(2)验证猜想3,可选用氧化铜固体(氧化铜和盐酸反应生成氯化铜和水,过程中固体溶解,溶液由无色变蓝色)、金属镁(镁和盐酸反应生成氯化镁和氢气,过程中固体溶解,产生气泡)。
故答案为:BC。
[点评]
本题考查了"实验探究物质的组成成分以及含量,酸的化学性质,",属于"易错题",熟悉题型是解题的关键。

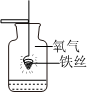
 暖宝宝是一种防寒用品,如图所示。小英见后思考:暖宝宝中的主要成分有哪些?发热的原因是什么?
暖宝宝是一种防寒用品,如图所示。小英见后思考:暖宝宝中的主要成分有哪些?发热的原因是什么?