[考点]
实验探究物质的组成成分以及含量,浓硫酸的性质及浓硫酸的稀释,酸的化学性质,中和反应及其应用,溶液的酸碱性与pH的关系,
[答案]
(1)水的质量;
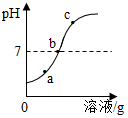
(2)b;
(3)氧化铁粉末溶解,溶液由无色变为黄色;氢氧化钠能使酚酞溶液变红色,反应后溶液显无色;氯化钡和硫酸、硫酸钠均能反应生成硫酸钡沉淀;
(4)H2SO4+2NaOH=Na2SO4+2H2O;
(5)ABD。
[解析]
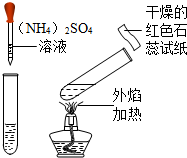
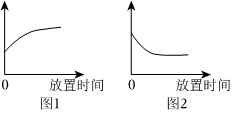
解:(1)浓硫酸具有吸水性,则溶液中水的质量会增大,由于其中的溶质质量不变,则溶质质量分数会减小,则图1曲线纵坐标表示水的质量;
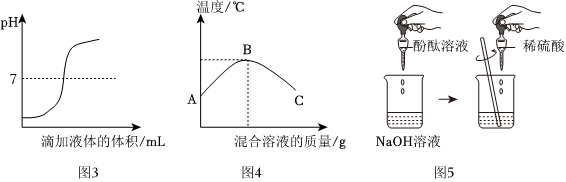
(2)由图可知,刚开始时溶液pH<7,显酸性,最终pH>7,显碱性,则说明是将氢氧化钠溶液滴入稀硫酸中,故选:b;
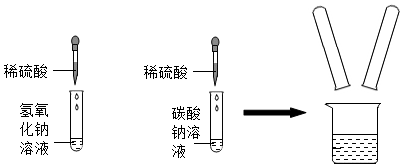
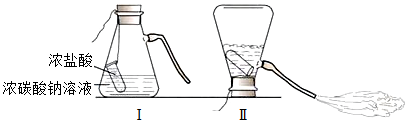
(3)结论为猜想二正确,即反应后溶液中溶质的成分是Na2SO4和H2SO4,而硫酸和氧化铁反应生成硫酸铁和水,则现象为氧化铁粉末溶解,溶液由无色变为黄色,由于氢氧化钠能使酚酞溶液变红色,而反应后溶液显无色,则可知溶液中不含氢氧化钠,则猜想三无需验证,便可知其不成立,由于氯化钡和硫酸、硫酸钠均能反应生成硫酸钡沉淀,则无法证明溶液中是否含有硫酸,故戊同学认为方案二是不合理的;
(4)硫酸与氢氧化钠反应生成硫酸钠和水,反应的化学方程式为H2SO4+2NaOH=Na2SO4+2H2O;
(5)A、硫酸能使紫色石蕊试液变成红色,能证明溶液中含有硫酸,故A符合题意;
B、铁能和硫酸反应生成硫酸亚铁和氢气,能证明溶液中含有硫酸,故B符合题意;
C、氢氧化钾和硫酸反应无明显现象,不能证明是否含有硫酸,故C不符合题意;
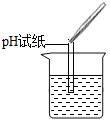
D、硫酸溶液显酸性,溶液pH<7,则能用pH试纸证明含有硫酸,故D符合题意;
故选:ABD。
故答案为:(1)水的质量;
(2)b;
(3)氧化铁粉末溶解,溶液由无色变为黄色;氢氧化钠能使酚酞溶液变红色,反应后溶液显无色;氯化钡和硫酸、硫酸钠均能反应生成硫酸钡沉淀;
(4)H2SO4+2NaOH=Na2SO4+2H2O;
(5)ABD。
[点评]
本题考查了"实验探究物质的组成成分以及含量,浓硫酸的性质及浓硫酸的稀释,酸的化学性质,中和反应及其应用,溶液的酸碱性与pH的关系,",属于"压轴题",熟悉题型是解题的关键。
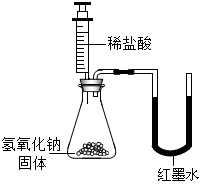


 为探究氢氧化钡溶液和稀盐酸反应后所得溶液中溶质的成分,小宇和同学们通过测定了反应过程中溶液的 pH,得到了如图所示曲线,请回答:
为探究氢氧化钡溶液和稀盐酸反应后所得溶液中溶质的成分,小宇和同学们通过测定了反应过程中溶液的 pH,得到了如图所示曲线,请回答: 暖宝宝是一种防寒用品,如图所示。小英见后思考:暖宝宝中的主要成分有哪些?发热的原因是什么?
暖宝宝是一种防寒用品,如图所示。小英见后思考:暖宝宝中的主要成分有哪些?发热的原因是什么?