[考点]
实验探究物质的组成成分以及含量,酸的化学性质,碱的化学性质,
[答案]
(1)能;
(2)NaCl、HCl;
(3)Na2CO3+2HCl=2NaCl+CO2↑+H2O;ABDE;
(4)复分解反应;
(5)反应物是否有剩余。
[解析]
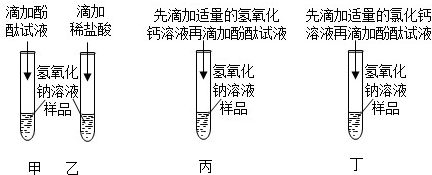
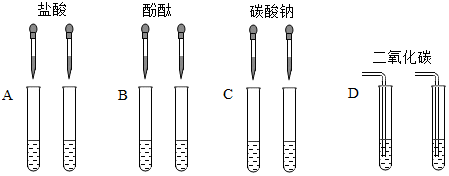
解:(1)小刚同学向反应后的溶液中加入无色酚酞溶液,观察到溶液仍为无色,说明溶液不显碱性,而氢氧化钠溶液显碱性,加入稀盐酸后溶液不呈碱性,能证明二者发生了化学反应;
(2)氢氧化钠溶液和盐酸反应生成氯化钠和水,向反应后的溶液中加入无色酚酞溶液,观察到溶液仍为无色,说明溶液不显碱性,即溶液中无氢氧化钠,可能二者恰好完全反应,也可能盐酸过量,猜想1:NaCl,则猜想2:NaCl、HCl;
(3)碳酸钠和盐酸反应生成氯化钠、二氧化碳和水,反应的化学方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O,猜想2成立,即反应后溶液中的溶质是NaCl、HCl;
A、镁能与盐酸反应生成氯化镁和氢气,产生气泡,则说明盐酸过量,故A符合题意;
B、氧化铁盐酸反应生成氯化铁和水,可观察到溶液由无色变成黄色,则说明盐酸过量,故B符合题意;
C、硝酸银和氯化钠、盐酸反应均会产生白色沉淀,不能用于盐酸过量,则C不符合题意;
D、碳酸钙与盐酸反应生成氯化钙、二氧化碳和水,观察到有气泡产生,说明盐酸过量,故D符合题意;
E、紫色石蕊溶液遇酸性溶液变红,遇中性溶液不变色,若观察到紫色石蕊溶液变红,则说明盐酸过量,故E符合题意;
故选:ABDE;
(4)氢氧化钠溶液和盐酸反应生成氯化钠和水,该反应是由两种化合物相互交换成分生成另外两种化合物的反应,属于复分解反应;
(5)通过上述实验,反应后所得溶液中溶质的成分,除了考虑生成物外,还应该考虑有反应物是否有剩余。
故答案为:(1)能;
(2)NaCl、HCl;
(3)Na2CO3+2HCl=2NaCl+CO2↑+H2O;ABDE;
(4)复分解反应;
(5)反应物是否有剩余。
[点评]
本题考查了"实验探究物质的组成成分以及含量,酸的化学性质,碱的化学性质,",属于"难典题",熟悉题型是解题的关键。
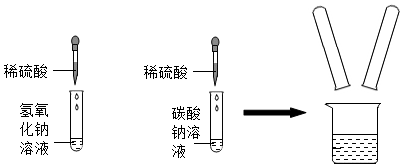

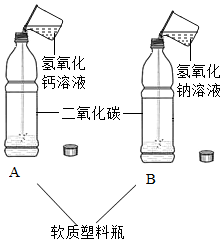 实验室在做有关CO2的性质实验中,用氢氧化钠溶液吸收CO2,而不用澄清石灰水,小喵同学想用以下A、B两组对比试验进行验证(实验后立即盖紧瓶盖并振荡);
实验室在做有关CO2的性质实验中,用氢氧化钠溶液吸收CO2,而不用澄清石灰水,小喵同学想用以下A、B两组对比试验进行验证(实验后立即盖紧瓶盖并振荡);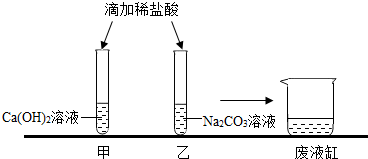 实验结束,甲、乙同学依次将废液缓慢倒入同一洁净的废液缸中,然后进行了讨论。
实验结束,甲、乙同学依次将废液缓慢倒入同一洁净的废液缸中,然后进行了讨论。