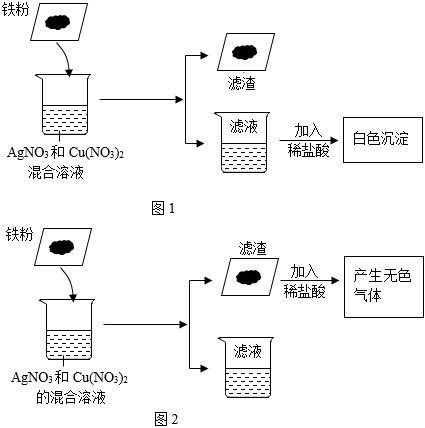
[解析]
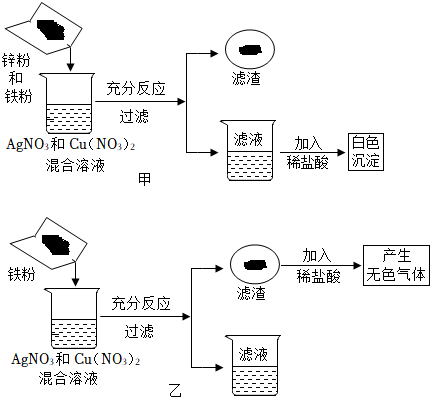
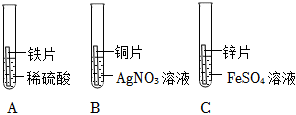
解:(1)活动性铁>铜>银,则铁先和硝酸银反应生成硝酸亚铁和银,如铁有剩余再和硝酸铜反应生成硝酸亚铁和铜。
加入稀盐酸观察到有白色沉淀产生,则说明有硝酸银剩余,则确定铁完全反应,硝酸铜未参加反应。
①可以确定一定有硝酸亚铁生成,有硝酸银剩余,硝酸铜未参加反应。硝酸亚铁中含有金属阳离子亚铁离子,硝酸银中含有金属阳离子银离子,硝酸铜中含有的金属阳离子为铜离子,则滤液中一定含有的金属离子为Fe2+、Ag+、Cu2+。
②只发生了铁和硝酸银的反应,所以产生滤渣发生的化学方程式为Fe+2AgNO3=Fe(NO3)2+2Ag。
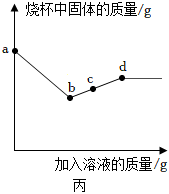
(2)向滤渣中加入稀盐酸,观察到有无色气体产生。三种金属中只有铁的活动性比氢强,所以一定有铁剩余。
①产生的无色气体为氢气,由铁和稀盐酸反应产生。化学式H2。
②滤渣中一定有铁,则铜和银一定被全部置换出来,则滤渣中一定含有Fe、Cu、Ag。
故答案为:(1)Fe2+、Ag+、Cu2+;Fe+2AgNO3=Fe(NO3)2+2Ag。
(2)H2;Fe、Cu、Ag。


 ?
?