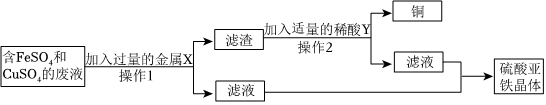
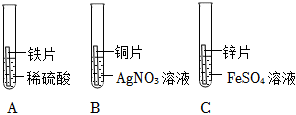
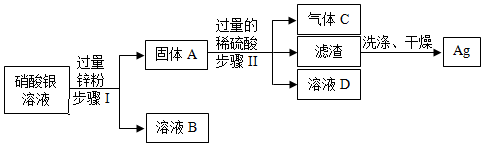
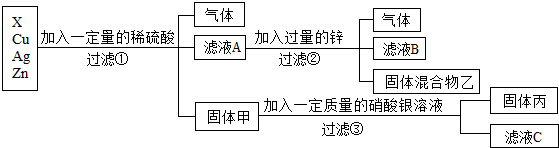
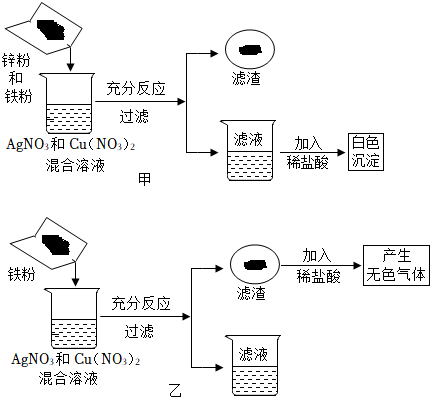
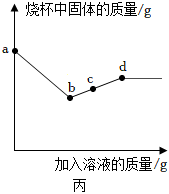
[解析]
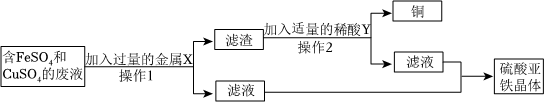
解:(1)烧铁器淬于胆矾水中,即成铜色也。”其中胆矾指硫酸铜的晶体,铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为Fe+CuSO4=FeSO4+Cu。
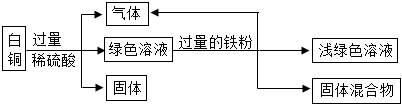
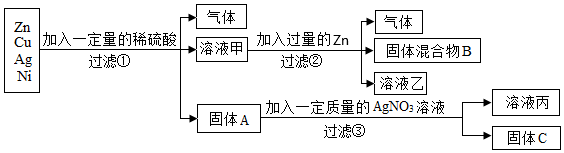
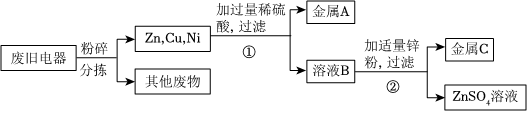
(2)白铜一般为铜、镍合金,加入过量稀硫酸,生成绿色溶液和气体,得到固体,铜和稀硫酸不反应,则与稀硫酸反应的金属是镍,说明镍的位置排在氢的前面,铜的位置排在氢的后面;绿色溶液中加入过量的铁粉,达到浅绿色溶液和固体混合物,说明铁的金属活动性比镍强,则由上述流程可知铁、铜、镍三种金属活动性由强到弱的顺序为铁、镍、铜。
向一定量的CuSO4溶液中加入铁粉与镍粉的混合物,铁粉先与硫酸铜溶液反应生成硫酸亚铁溶液和铜,铁粉反应完,若还有硫酸铜溶液,镍再与硫酸铜溶液反应生成硫酸镍和铜;充分反应后过滤,得到滤液甲和滤渣乙。若向滤渣乙中滴加稀盐酸,无气泡产生,说明铁、镍均完全反应,无法确定硫酸铜是否有剩余,则滤液甲中一定含有的溶质是硫酸亚铁、硫酸镍,含有的金属阳离子是Fe2+和Ni2+。
故答案为:
(1)Fe+CuSO4=FeSO4+Cu;
(2)铁、镍、铜;Fe2+和Ni2+。


 ?
?