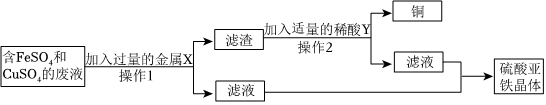
[答案]
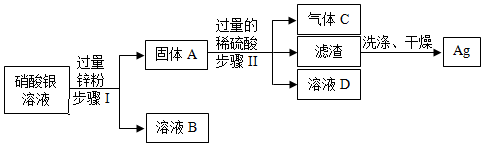
(1)过滤;Cu、Zn、Fe;
(2)ZnSO4;
(3)Zn+CuSO4=ZnSO4+Cu;Zn+H2SO4=ZnSO4+H2↑。
[解析]
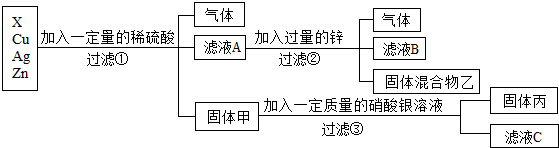
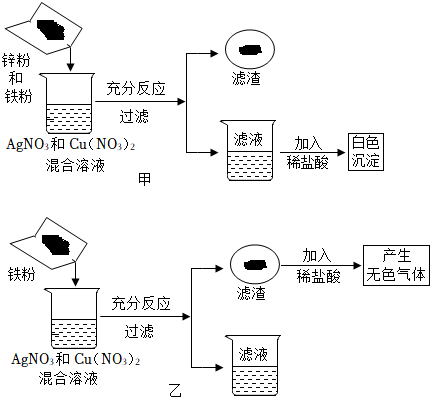
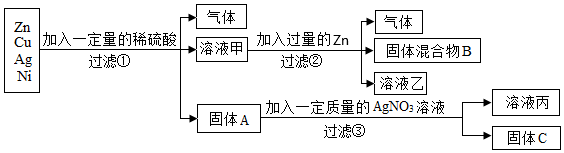
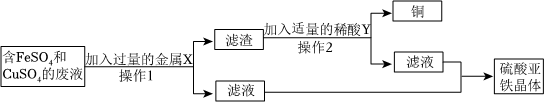
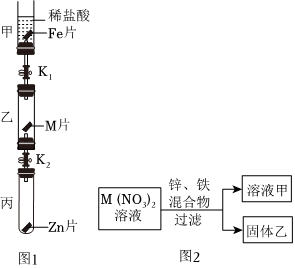
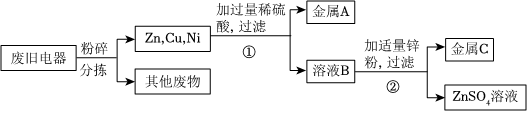
解:(1)操作1把混合物分离成固体和滤液,所以,操作1为过滤操作;根据金属活动性锌>铁>铜,向含有CuSO4、ZnSO4、FeSO4的废液加入过量的锌粉,铁、铜被置换出来,因此过滤后所得固体A中含有铁、铜和未反应的锌;
故答案为:过滤;Cu、Zn、Fe;
(2)根据金属的活动性锌>铁>氢>铜,向CuSO4、ZnSO4、FeSO4混合溶液中加入过量锌粉后过滤,所得滤液为ZnSO4溶液;把铜粉与锌粉的混合物放入足量稀硫酸中充分反应后过滤,所得滤液为ZnSO4溶液;
故答案为:ZnSO4;
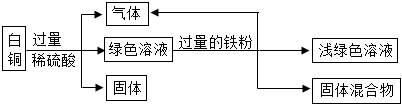
(3)若实际操作过程中加入锌粉的量不足,则一定发生的反应的化学方程式为Zn+CuSO4=ZnSO4+Cu。
铜粉与锌粉的混合物中的锌粉能与稀硫酸发生置换反应生成硫酸锌和氢气,反应的化学方程式是Zn+H2SO4=ZnSO4+H2↑。
故答案为:Zn+CuSO4=ZnSO4+Cu;Zn+H2SO4=ZnSO4+H2↑。
[点评]
本题考查了"金属的化学性质,",属于"基础题",熟悉题型是解题的关键。



 ?
?