[解析]
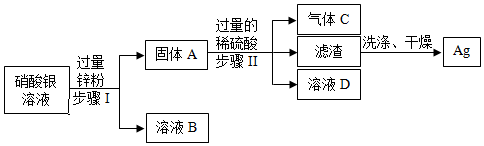
解:金属活动性顺序可知,铝>锌>铁>铜>银,由题意可知,向含有Cu(NO3)2、Fe(NO3)2、AgNO3、Al(NO3)3的混合液中加入一定量的锌粉,锌粉会首先置换硝酸银中的银,待硝酸银完全反应后继续与硝酸铜发生反应,硝酸铜完全反应后继续与硝酸亚铁反应,所以
(1)滤渣中只含有一种金属,则发生的是锌和硝酸银反应生成硝酸锌和银,反应的化学方程式为Zn+2AgNO3═Zn (NO3)2+2Ag;
(2)若滤液为浅绿色,则滤液中一定含有硝硝酸亚铁,未参加反应的硝酸铝,反应生成的硝酸锌,滤渣中一定含有铜、银,可能含有铁;
(3)若滤渣中加足量稀盐酸很快产生大量气泡,一段时间后产生气泡速率明显减慢,说明含有两种金属,即铁和锌,说明Cu(NO3)2、AgNO3已经完全反应,则刚加盐酸时发生的反应为锌和稀盐酸反应,发生反应的方程式为Zn+2HCl=ZnCl2+H2↑,滤液中含有的阳离子有Zn2+、Al3+。
故填:(1)Zn+2AgNO3═Zn (NO3)2+2Ag;
(2)硝酸亚铁、硝酸铝、硝酸锌;铁;
(3)Zn+2HCl=ZnCl2+H2↑;Zn2+、Al3+。



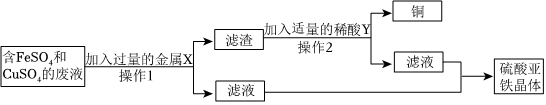
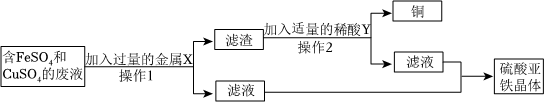
 ?
?