[解析]
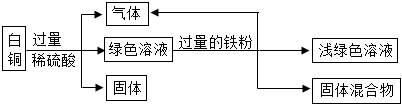
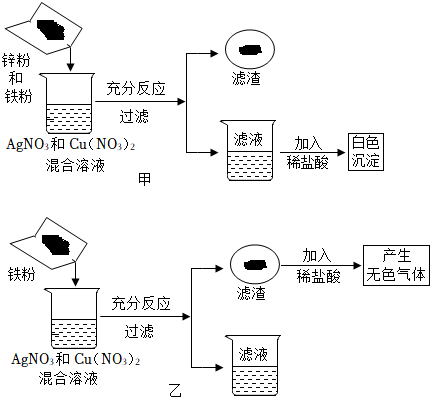
解:(1)图甲中,滤液加入稀盐酸产生白色沉淀,说明滤液中一定含有硝酸银,则此时锌、铁和铜都不能以单质的形式存在,故滤液中的金属离子种类有4种;
(2)图乙中,滤渣计入稀盐酸产生气体,故滤渣中一定含有铁,则银和铜都不能以盐的形式存在于滤液中,故滤液中一定只含有Fe(NO3)2;
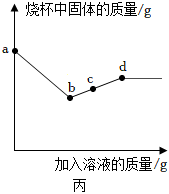
(3)取少量乙组滤渣于烧杯中逐滴加入稀硫酸,一段时后再逐滴加入硫酸铜溶液,a﹣b段固体质量减少,故是铁与稀硫酸反应产生硫酸亚铁和氢气,所发生的反应方程式为Fe+H2SO4═FeSO4+H2↑;
A.a﹣b段铁和硫酸反应,会导致溶液质量逐渐增加,A正确;
B.b﹣d段固体的质量增加,说明铁与硫酸铜反应生成了硫酸亚铁和铜,b点时溶液中的溶质是硫酸亚铁,c点时溶液中的溶质是铁和硫酸铜反应生成的硫酸亚铁,故b、c点溶液中溶质种类相同,B错误;
C.d点时固体质量不再改变,说明d点铁已经全部反应,故b、c、d点对应固体中加入稀硫酸,d点没有气泡产生,C错误;
D.d点时铁全部参与反应,故c点溶液中铁元素的质量小于d点溶液,D正确;
故答案为:(1)4;
(2)Fe(NO3)2;
(3)Fe+H2SO4═FeSO4+H2↑;AD。


 ?
?