服务热线
搜题▪组卷
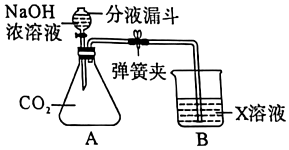
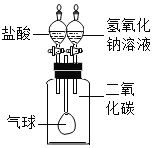
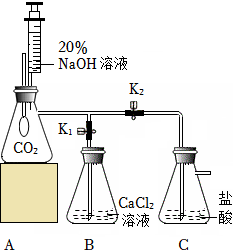 小明同学按图示装置验证CO2和NaOH溶液发生了反应。关闭K1、K2,将20%NaOH溶液注入装满CO2的锥形瓶中,观察到气球胀大。
小明同学按图示装置验证CO2和NaOH溶液发生了反应。关闭K1、K2,将20%NaOH溶液注入装满CO2的锥形瓶中,观察到气球胀大。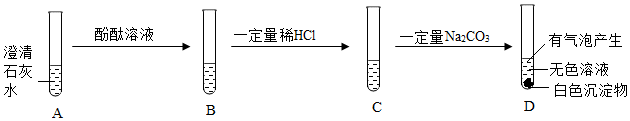
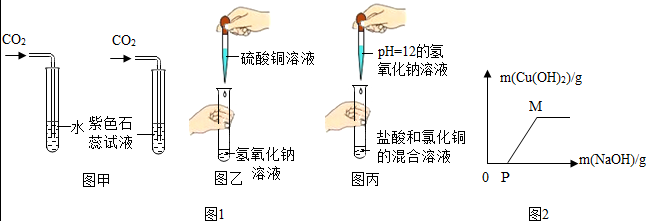
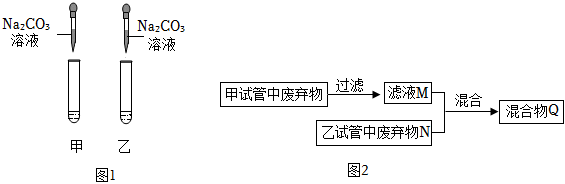
| 实验 | 实验1 | 实验2 | 实验3 | 实验4 |
| 实验操作 |  |
 |
 |
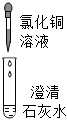 |
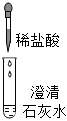
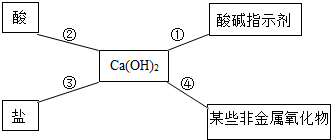
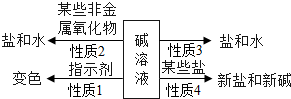
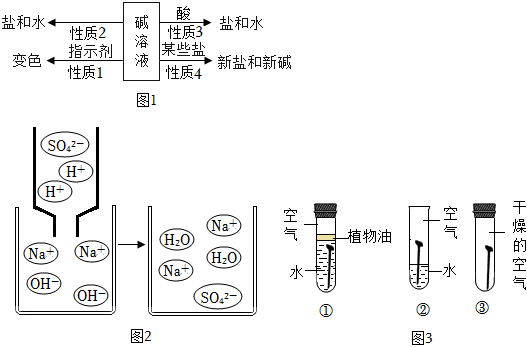
| 现象 | 溶液变红色 | 石灰水变浑浊 | 无明显现象 | 生成蓝色沉淀 |
| 结论或解释 | 氢氧化钙能与酚酞等酸碱指示剂反应 | CO2能与氢氧化钙反应 | / | 氢氧化钙能与某些盐反应 |
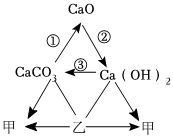
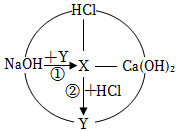 如图是初中常见物质的反应关系,其中X俗称苏打,“→”表示某物质可一步反应生成另一种物质,“—”表示两端的物质能相互反应(部分生成物已略去)。回答下列问题。
如图是初中常见物质的反应关系,其中X俗称苏打,“→”表示某物质可一步反应生成另一种物质,“—”表示两端的物质能相互反应(部分生成物已略去)。回答下列问题。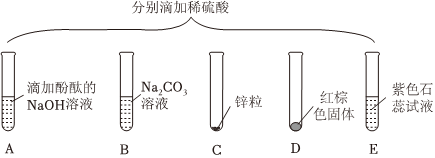


dcyh2021
2021-08-06
初中化学 | | 填空题