[考点]
酸的化学性质,溶液的酸碱性与pH的关系,书写化学方程式、文字表达式、电离方程式,
[答案]
(1)溶液由红色变成无色;
(2)Zn+H2SO4=ZnSO4+H2↑;
(3)Fe2O3;
(4)Na+、Zn2+、Fe3+。
[解析]
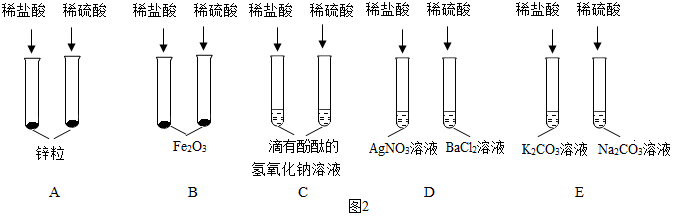
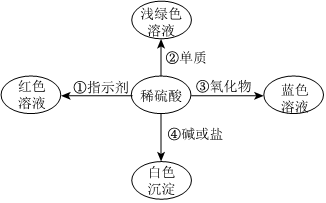
解:(1)滴有酚酞氢氧化钠溶液呈红色,如果稀硫酸和氢氧化钠反应后氢氧化钠消失,则溶液会由红色变为无色,则能证明A中反应发生的现象是:溶液由红色变成无色、红色消失或红色褪去。
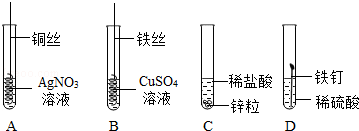
(2)由图可知,C试管中发生的反应是金属锌和硫酸反应生成硫酸锌和氢气,反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑。
(3)酸的化学通性有:酸和碱反应、酸和某些盐反应、酸和活泼金属反应、酸和金属氧化物反应、酸和酸碱指示剂作用,由图可知,还少一个酸和金属氧化物反应的实验,则D试管中能与酸反应的固体物质为金属氧化物,而且还是红棕色固体,即为氧化铁,其化学式为Fe2O3。
(4)实验完成后,将全部废液倒入废液缸内,测得pH=2,则溶液呈酸性,溶液中不可能存在氢氧化钠和碳酸钠,则溶液存在的溶质主要有氢氧化钠、碳酸钠与盐酸反应生成的氯化钠,氧化铁和盐酸反应生成的氯化铁,金属单质锌与盐酸反应生成的氯化锌,还有剩余的盐酸共四种,所以废液中所含的金属阳离子有:Na+、Zn2+、Fe3+。
故答案为:
(1)溶液由红色变成无色;
(2)Zn+H2SO4=ZnSO4+H2↑;
(3)Fe2O3;
(4)Na+、Zn2+、Fe3+。
[点评]
本题考查了"酸的化学性质,溶液的酸碱性与pH的关系,书写化学方程式、文字表达式、电离方程式,",属于"典型题",熟悉题型是解题的关键。
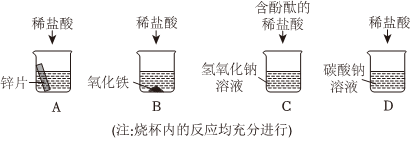
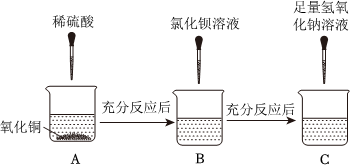
 为验证“酸的化学通性”,某班同学在实验室进行了如下实验,请分析并回答相关问题
为验证“酸的化学通性”,某班同学在实验室进行了如下实验,请分析并回答相关问题
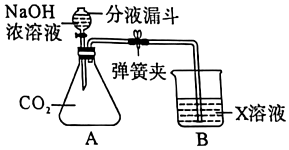
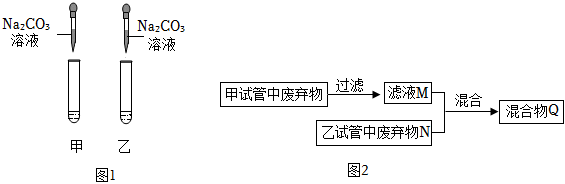
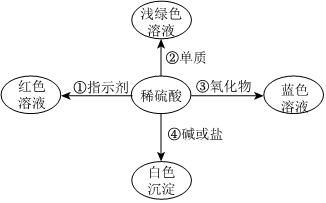
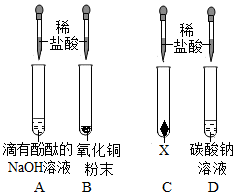
 为验证酸碱盐和氧化物的性质与转化,某同学设计如下实验。
为验证酸碱盐和氧化物的性质与转化,某同学设计如下实验。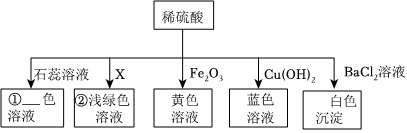
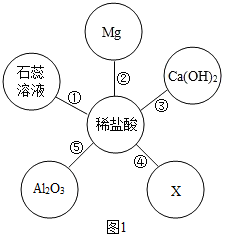
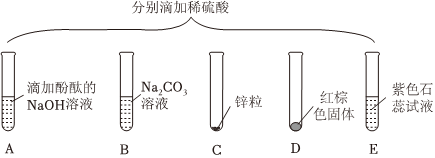
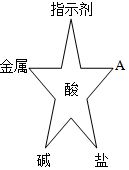 在化学复习课上,同学们对酸的化学性质进行了梳理和概括,并用如图表达了他们的研究成果。请你根据图回答下列问题。
在化学复习课上,同学们对酸的化学性质进行了梳理和概括,并用如图表达了他们的研究成果。请你根据图回答下列问题。