服务热线
搜题▪组卷
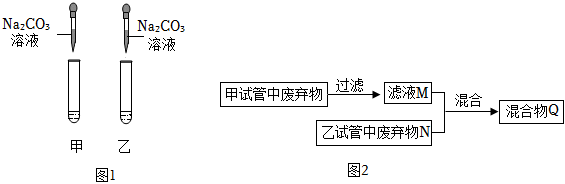
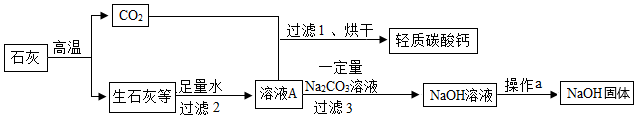
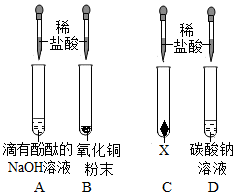 为验证“酸的化学通性”,某班同学在实验室进行了如下实验,请分析并回答相关问题
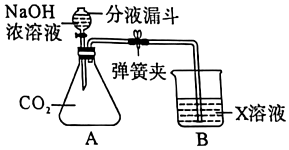
为验证“酸的化学通性”,某班同学在实验室进行了如下实验,请分析并回答相关问题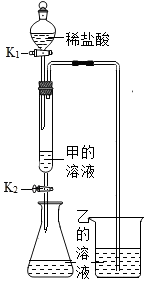 如图所示,(夹持仪器略去,K1、K2均关闭),打开K1待分液漏斗中的液体全部流下,立即关闭K1,观察到产生大量气泡,且烧杯中乙的溶液变浑浊。充分反应后,打开K.和K2,使液体全部流入锥形瓶。
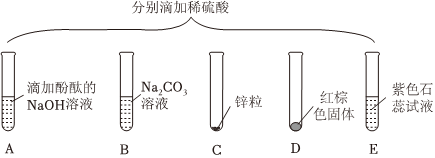
如图所示,(夹持仪器略去,K1、K2均关闭),打开K1待分液漏斗中的液体全部流下,立即关闭K1,观察到产生大量气泡,且烧杯中乙的溶液变浑浊。充分反应后,打开K.和K2,使液体全部流入锥形瓶。| 实验 | A+B | A+C | B+C | B+D |
| 现象 | 溶液变红 | 溶液变红 | 产生沉淀 | 产生气体 |
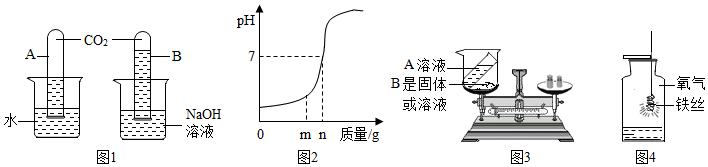
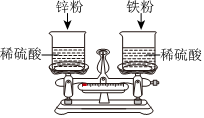 如图,托盘上各放一只等质量的烧杯,分别盛有等质量、等质量分数的稀硫酸,天平平衡,再向烧杯中分别加入等质量的铁粉和锌粉。
如图,托盘上各放一只等质量的烧杯,分别盛有等质量、等质量分数的稀硫酸,天平平衡,再向烧杯中分别加入等质量的铁粉和锌粉。
jr@dyw.com
2023-06-02
初中化学 | | 填空题