[考点]
空气组成的测定,质量守恒定律及其应用,氢气的制取、收集与检验,
[答案]
(1)分液漏斗;
(2)Zn+H2SO4=ZnSO4+H2↑;C;
(3)②;
(4)24。
[解析]
解:(1)图中①仪器名称为分液漏斗;
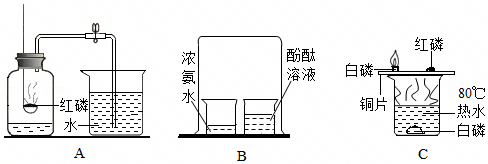
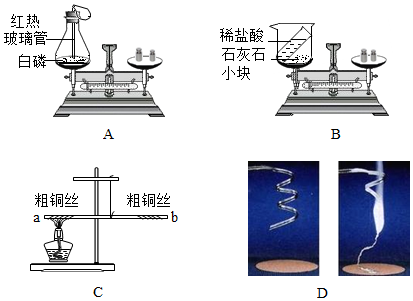
(2)锌与稀硫酸反应生成硫酸锌和氢气,该反应方程式为Zn+H2SO4=ZnSO4+H2↑;装置C中当打开弹簧夹时,长颈漏斗内的液体在重力作用下进入试管,使试管内液面上升到多孔隔板以上,与固体试剂接触,开始反应;当关闭弹簧夹时,产生的气体无法排出,在试管上半部分聚积,使试管内部气压增大,将液体压回到长颈漏斗,使液面降到多孔隔板以下,使反应物相互分离,反应停止,故C装置的优点是可随时控制反应的发生与停止,所以为了实验安全并节约药品,需要及时终止反应,此时应选择的最佳发生装置为C;
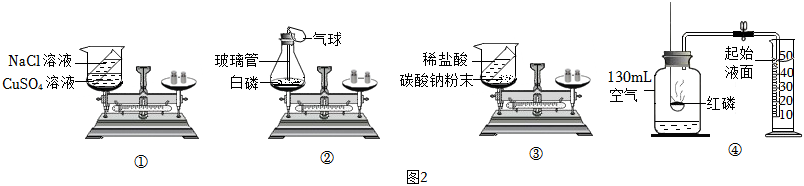
(3)①中氯化钠与硫酸铜溶液不发生反应,不能用于验证质量守恒定律;
②中白磷燃烧生成五氧化二磷,该反应在密闭容器镁进行,可以用来验证质量守恒定律;
③中稀盐酸与碳酸钠反应生成氯化钠、二氧化碳和水,该反应在敞口容器中进行,生成的二氧化碳气体逸出装置,不能用于验证质量守恒定律;
故选②;
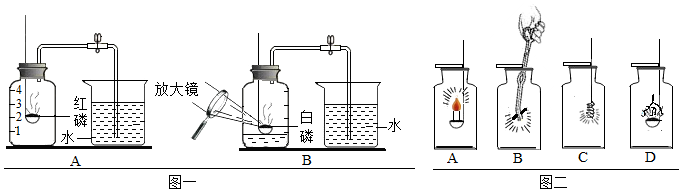
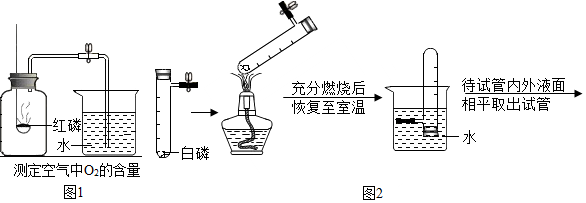
(4)红磷燃烧消耗集气瓶中的氧气,根据氧气约占空气体积的五分之一,故消耗氧气的体积为130mL×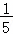 =26mL,所以量筒中液面理论上约降低到50mL﹣26mL=24mL刻度线处。
故答案为:(1)分液漏斗;
(2)Zn+H2SO4=ZnSO4+H2↑;C;
(3)②;
(4)24。
=26mL,所以量筒中液面理论上约降低到50mL﹣26mL=24mL刻度线处。
故答案为:(1)分液漏斗;
(2)Zn+H2SO4=ZnSO4+H2↑;C;
(3)②;
(4)24。
[点评]
本题考查了"空气组成的测定,质量守恒定律及其应用,氢气的制取、收集与检验,",属于"难典题",熟悉题型是解题的关键。
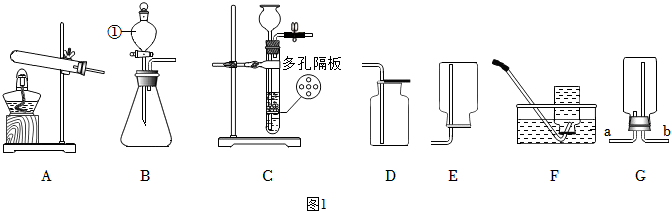

 分析如图实验,回答下列问题:
分析如图实验,回答下列问题: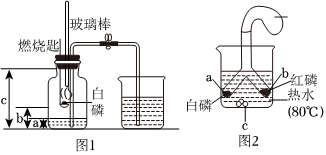 ?
?