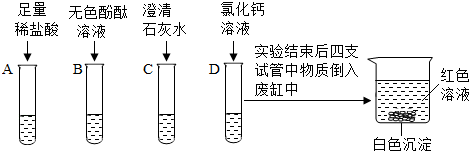
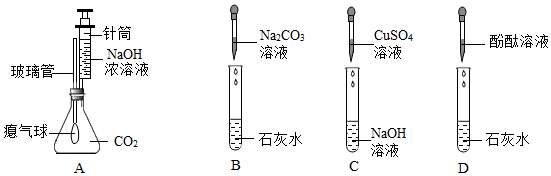
[考点]
实验探究物质的组成成分以及含量,常见气体的检验与除杂方法,质量守恒定律及其应用,
[答案]
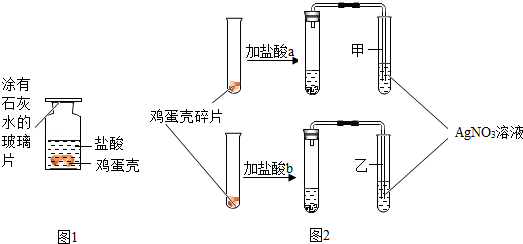
方案一:碳、氢;
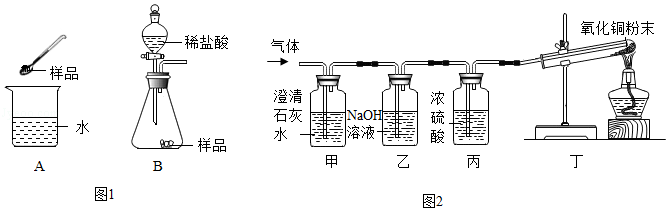
方案二:(1)排出装置中的空气;
(2)集中火焰、提高温度;
(3)烧杯内壁有水珠;
(4)澄清石灰水;澄清石灰水变浑浊;Ca(OH)2+CO2=CaCO3↓+H2O。
[解析]
解:方案一:根据质量守恒定律,化学反应前后元素种类不发生变化,生成物中有二氧化碳和水生成,说明反应物中也应该含有碳、氢、氧元素,而氧气中含有氧元素,因此蔗糖中一定含有碳、氢元素,可能含有氧元素,故小刚认为该方案不合理,实验只能说明蔗糖中一定含有碳、氢两种元素;故答案为:碳、氢;
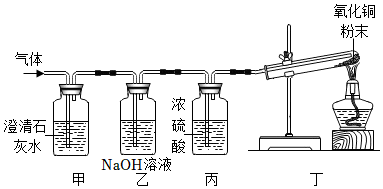
方案二:(1)氮气化学性质不活泼,先通入一会儿氮气的目的是排出装置中的空气,避免对实验结果造成干扰;故答案为:排出装置中的空气;
(2)实验中酒精灯加网罩的目的是集中火焰、提高温度;故答案为:集中火焰、提高温度;
(3)蔗糖在加强热的条件下反应,观察到烧杯内壁有小水珠产生,说明蔗糖分解有水生成,说明蔗糖中含有氢元素和氧元素;故答案为:烧杯内壁有水珠;
(4)木炭与氧气反应生成二氧化碳,验证二氧化碳常用澄清石灰水;二氧化碳通入澄清的石灰水生成碳酸钙沉淀和水,该反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O,故有澄清石灰水变浑浊的现象,故答案为:澄清石灰水;澄清石灰水变浑浊;Ca(OH)2+CO2=CaCO3↓+H2O。
[点评]
本题考查了"实验探究物质的组成成分以及含量,常见气体的检验与除杂方法,质量守恒定律及其应用,",属于"难典题",熟悉题型是解题的关键。
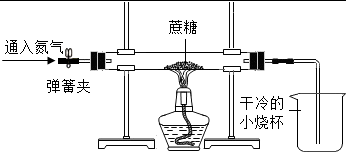
 ?
?