服务热线
搜题▪组卷
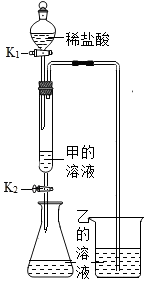 如图所示,(夹持仪器略去,K1、K2均关闭),打开K1待分液漏斗中的液体全部流下,立即关闭K1,观察到产生大量气泡,且烧杯中乙的溶液变浑浊。充分反应后,打开K.和K2,使液体全部流入锥形瓶。
如图所示,(夹持仪器略去,K1、K2均关闭),打开K1待分液漏斗中的液体全部流下,立即关闭K1,观察到产生大量气泡,且烧杯中乙的溶液变浑浊。充分反应后,打开K.和K2,使液体全部流入锥形瓶。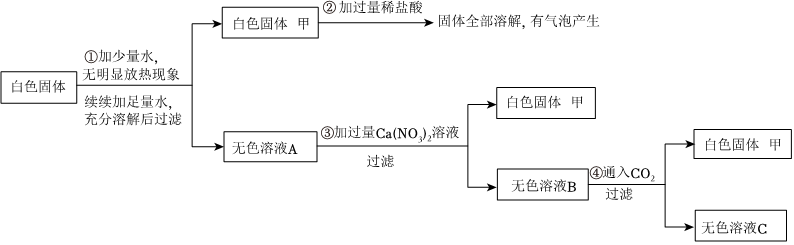


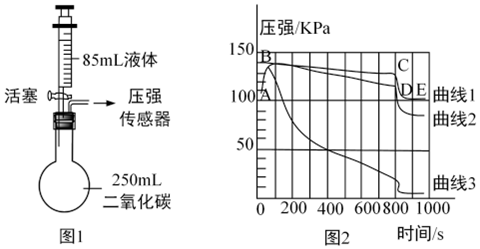
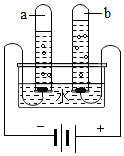 在宏观、微观和符号之间建立联系是化学特有的思维方式。根据电解水的实验,回答下列问题。
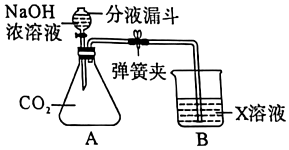
在宏观、微观和符号之间建立联系是化学特有的思维方式。根据电解水的实验,回答下列问题。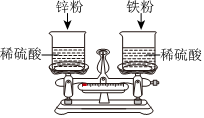 如图,托盘上各放一只等质量的烧杯,分别盛有等质量、等质量分数的稀硫酸,天平平衡,再向烧杯中分别加入等质量的铁粉和锌粉。
如图,托盘上各放一只等质量的烧杯,分别盛有等质量、等质量分数的稀硫酸,天平平衡,再向烧杯中分别加入等质量的铁粉和锌粉。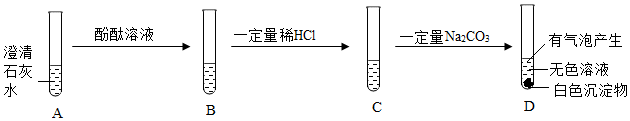

gcc@dyw.com
2018-03-22
初中化学 | | 填空题