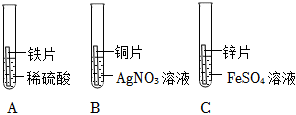
[解析]
解:(1)右边烧杯中铁与硫酸反应生成硫酸亚铁和氢气,硫酸亚铁溶液显浅绿色,故右边烧杯中溶液的颜色为浅绿色。
(2)左边烧杯中锌与硫酸反应生成硫酸锌和氢气,反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑。
(3)由于锌的金属活动性比铁强,开始的时候锌产生的氢气快,铁生成的氢气慢,所以天平的指针先向右偏转,再向左偏转,故反应初始,观察到天平指针向右偏转。
(4)①铁、锌与硫酸反应的化学方程式分别是Fe+H2SO4=FeSO4+H2↑、Zn+H2SO4=ZnSO4+H2↑,由以上反应可看出要得到2份等质量的氢气,需要铁56份,锌65份,说明质量相等的铁、锌分别与足量的稀硫酸反应,铁生成的氢气多,锌生成的氢气少,则加锌这边剩余的质量大,天平的指针最终指向左边,为使天平再次平衡,可将游码右移,故说法正确。
②反应结束后,两烧杯中的金属完全消失,说明金属完全反应。由①的解析可知,质量相等的铁、锌分别与稀硫酸反应,铁消耗硫酸多,锌消耗硫酸少,左边烧杯中的硫酸一定有剩余,右边烧杯中的硫酸可能恰好用完,也可能有剩余,故右边烧杯中对应溶液的溶质可能是生成的硫酸亚铁,也可能是生成的硫酸亚铁和剩余的硫酸,故说法正确。
③由②中解析可知,左边烧杯中的硫酸一定有剩余,右边烧杯中的硫酸可能恰好用完,也可能有剩余,将两烧杯中的所有物质倒入同一废液缸中,此时废液缸中溶液中一定有硫酸,溶液的pH<7,故说法正确。
故答案为:
(1)浅绿;
(2)Zn+H2SO4=ZnSO4+H2↑;
(3)右;
(4)①②③。
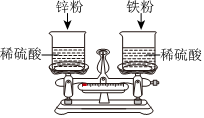 如图,托盘上各放一只等质量的烧杯,分别盛有等质量、等质量分数的稀硫酸,天平平衡,再向烧杯中分别加入等质量的铁粉和锌粉。
如图,托盘上各放一只等质量的烧杯,分别盛有等质量、等质量分数的稀硫酸,天平平衡,再向烧杯中分别加入等质量的铁粉和锌粉。


 ?
?