[答案]
(1)能;
(2)废液中不含AgNO3;
(3)MgSO4+Ba(NO3)2=BaSO4↓+Mg(NO3)2;
(4)镁、铜、银;
(5)C。
[解析]
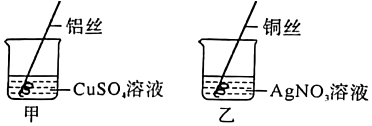
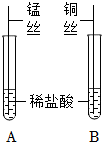
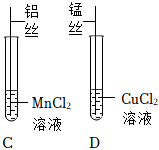
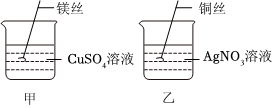
解:(1)在实验甲中,硫酸铜能与镁反应,说明镁的活动性大于铜,在实验乙中,硝酸银能与铜反应,说明铜的活动性大于银,通过这两个实验,可以得出三种金属的活动性顺序为Mg>Cu>Ag;故答案为:能;
(2)硝酸银与稀盐酸会反应生成氯化银白色沉淀,取少量废液于试管中,加入稀盐酸,观察到无明显现象,说明废液中不含AgNO3;故答案为:废液中不含AgNO3;
(3)实验2中加入Ba(NO3)2溶液,观察到有白色沉淀产生,得出结论废液中含有未反应完的CuSO4不合理;因为甲实验中镁与硫酸铜反应会生成硫酸镁,硫酸镁也能与Ba(NO3)2反应生成硫酸钡白色沉淀,化学方程式为MgSO4+Ba(NO3)2=BaSO4↓+Mg(NO3)2;故答案为:MgSO4+Ba(NO3)2=BaSO4↓+Mg(NO3)2;
(4)实验甲中所得溶液的溶质中一定存在硫酸镁,可存在硫酸铜,固体中一定存在铜,实验乙所得溶液的溶质中一定硝酸铜,固体一定是存在银;将甲、乙中的溶液倒入同一烧杯中,并将过量的镁粉加入废液中,镁能将硝酸铜、硫酸铜中铜置换出来,充分反应后过滤,滤渣中存在的金属是铜、银(实验乙中生成)、镁(过量);故答案为:镁、铜、银;
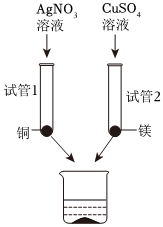
(5)镁和硫酸铜反应生成硫酸镁和铜,铜和硝酸银反应生成硝酸铜和银,待反应停止后将所得混合物倒入同一洁净的烧杯中,镁也会与硝酸铜、硝酸银反应,充分混合后分离得到滤渣m和滤液n;金属活动顺序Mg>Cu>Ag,当镁加入硝酸银、硝酸铜混合溶液时,硝酸银先与镁反应,硝酸银完全反应后,若镁有剩余再与硝酸铜反应;
A、若滤液n为无色,说明滤液n中不含硝酸铜,也一定不含硝酸银,滤渣m组成情况可能有①铜、银,②铜、银、镁,滤渣m组成情况可能有2种,故选项说法错误;
B、若滤渣m中有红色固体(铜),红色固体是镁和硫酸铜反应生成铜,滤液中一定存在硫酸镁,硝酸银一定完全反应,不能确定硫酸铜是否一定完全反应,滤液n中无法确定的金属离子有一种,故选项说法错误;
C、试管1和试管2中的反应停止后,试管1分为:①恰好完全反应;②AgNO3过量;③Cu 过量;试管2分为:①恰好完全反应;②CuSO4过量;③镁过量,当试管2镁过量时,一定发生反应是镁与硝酸铜反应生成硝酸和铜,每24份质量的镁和硝酸铜反应生成硝酸镁和64份质量的铜,固体质量增大,可能反应的反应是镁与硝酸银反应生成硝酸镁和银,每24份质量的镁和硝酸银反应生成硝酸镁和216份质量的银,固体质量也增大;当固体都完全反应时,前后的固体质量相等,所以此时所得固体质量之和一定不大于滤渣m的质量,
故选:C。
[点评]
本题考查了"金属活动性的探究,",属于"常考题",熟悉题型是解题的关键。
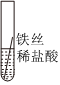
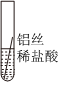
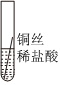
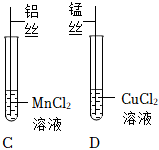
 某化学兴趣小组的同学为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动。
某化学兴趣小组的同学为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动。