服务热线
搜题▪组卷
| 实验操作 | 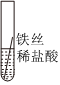 |
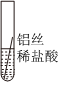
|
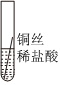
|
| 实验现象 | 缓慢产生少量气泡 | 快速产生大量气泡 | 无气泡 |
| 实验步骤 | 实验现象 | 解释与结论 |
| 取两支试管,分别向其中加入一定量的硫酸锌溶液和硫酸铜溶液,然后将大小、形状相同的镍片分别插入两支试管中。 | 插入硫酸铜溶液中的镍片表面出现红色固体物质,另一支试管无明显变化。 | 猜想 正确。镍与硫酸铜反应的化学方程是 。 |
| 金属 | Ni | Zn | Cu |
| 与盐酸反应的现象 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生迅速,金属很快溶解 | 无明显现象 |
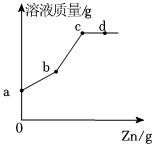
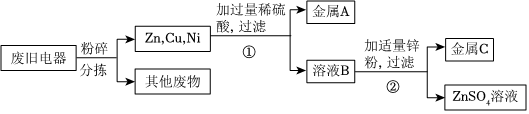
 某化学兴趣小组的同学为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动。
某化学兴趣小组的同学为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动。| 方案 | 主要操作 | 主要现象 | 实验结论 |
| 甲 | (1)将打磨好的粗细相同的R丝、铁丝,分别放在酒精灯火焰上灼烧,并将铁丝趁热伸入装满氧气的集气瓶中 | R丝在空气中剧烈燃烧; 铁丝在纯氧中才能剧烈燃烧、火星四射,生成黑色固体。 |
金属活动性 |
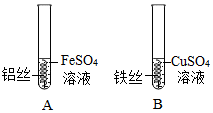
| (2)将打磨好的铁丝插入硫酸铜溶液中 | 铁丝表面附着红色固体,蓝色溶液变为浅绿色 | 金属活动性:Fe>Cu | |
| 乙 | 将打磨好的粗细相同的R丝、铁丝、铜丝分别插入体积和浓度都相同的稀盐酸中 | R丝表面产生气泡速率比铁丝表面产生气泡速率 (选填“快”或“慢”),钢丝表面无气泡。 | 金属活动性R>Fe>Cu |
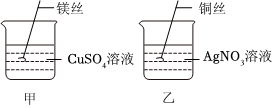
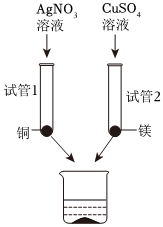
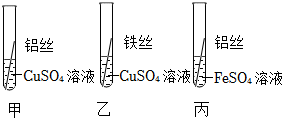
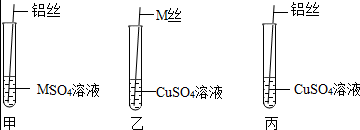
| 操作现象 | M丝插入试管Ⅰ | 铜丝插入试管Ⅱ | 铝丝插入试管Ⅲ | 结论 |
| 刚开始 | 少量气泡产生 | ② | 无气泡 | M>Cu、M>Al |
| 几分钟后 | 少量气泡产生 | 无气泡 | 有大量气泡产生 | Al>M>Cu |
| 主要操作 | 主要现象 | 实验结论 | |
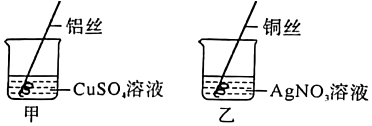
| 甲同学 | 打磨R丝,并将其插入到硫酸铜溶液中 | R丝表面覆盖了一层红色物质 | 猜想一不成立 |
| 乙同学 | 打磨粗细相同的R丝、铝丝、铜丝,分别将它们插入到等体积、等浓度的稀硫酸中 | ①R丝表面缓慢产生气泡,溶液由无色逐渐变成蓝色 ②铝丝表面 ③铜丝表面没有气泡产生 |
猜想二成立 |
| 丙同学 | 将铝丝插入 | 无明显现象 | 猜想三成立 |
| 序号 | 实验操作 | 实验现象 | 实验结论 |
| 实验1 | 取少量废液于试管中,加入 稀盐酸 溶液 | 无明显现象 | 废液中没有AgNO3 |
| 实验2 | 取少量废液于试管中,加入Ba(NO3)2溶液 | 产生白色沉淀 | 废液中含有未反应完的CuSO4 |
| 实验步骤 | 实验现象 | 实验结论 |
| 把镍浸入稀硫酸中 | (1) | 镍的活动性比氢强 |
| 把镍浸入硫酸亚铁溶液中 | 无明显现象 | 镍的活动性比铁(2) |
| 实验操作 | 铁片放在稀硫酸中 | 铜片放在稀硫酸中 | 铬片放在稀硫酸中 |
| 开始的现象 | 有少量气泡产生 | 无气泡 | 无气泡 |
| 结论 | 金属活动性强弱:Fe>Cu、Fe>Cr | ||
| 实验操作 | 铁片放在稀硫酸中 | 铜片放在稀硫酸中 | 铬片放在稀硫酸中 |
| 开始的现象 | 产生少量气泡 | 无气泡 | 产生大量气泡 |
| 结论 | 金属活动性强弱: > > (填元素符号) | ||
| 实验操作 | 实验现象 | 得出结论 |
| 加入适量 (填名称) | 无明显现象 | 假设c成立 |

| 编号 | 操作 | 现象 |
| 1 | 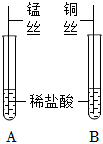 |
A试管中锰丝表面有气泡产生,溶液由无色变为浅粉色;B试管中一直无明显现象 |
| 2 | 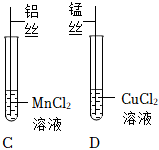 |
C试管中铝丝表面有固体析出,溶液由浅粉色变为无色;D试管中锰丝表面有固体析出,且溶液由 (填颜色变化) |
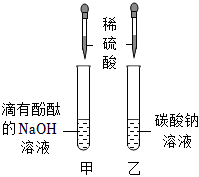
| 编号 | 操作 | 现象 |
| 3 | 取少量废液于试管中,加入过量的硝酸钡溶液 | ,溶液仍为红色 |
| 4 | 向上一步操作后的试管中加入足量稀硝酸 | 白色沉淀不溶解,溶液呈无色 |
| 编号 | 操作 | 现象 |
| 实验1 | 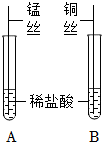 |
A试管中锰丝表面有气泡产生,溶液由无色变为浅粉色:写出A试管中的反应方程式: 。 B试管中无明显现象。 |
| 实验2 | 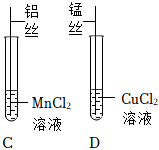 |
C试管中铝丝表面有固体生成,溶液由浅粉色变为无色; D试管中的现象是: 。 |

jr@dyw.com
2023-12-11
初中化学 | 九年级上 | 实验探究题