[考点]
实验探究物质的组成成分以及含量,碱的化学性质,盐的化学性质,
[答案]
(1)反应物消失;HCl+NaOH=NaCl+H2O;
(2)5mL蒸馏水;BaCl2(或CaCl2);有气泡产生,溶液由无色变为浅绿色;B。
[解析]
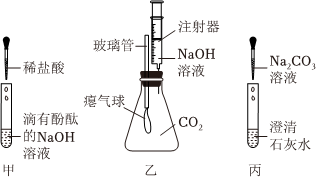
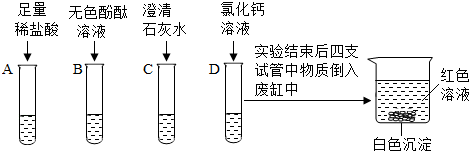
解:(1)C中为滴有酚酞的氢氧化钠溶液,一开始溶液中因为有氢氧化钠,溶液为红色,溶液由红色变为无色,说明溶液中没有氢氧化钠了,这是从反应物消失的角度证明了盐酸和氢氧化钠发生了反应,D试管内稀盐酸倒吸进C中,盐酸与氢氧化钠反应生成氯化钠和水,二者反应的化学方程式为HCl+NaOH=NaCl+H2O;
(2)用注射器向圆底烧瓶内缓慢注入5mL NaOH溶液,轻轻振荡烧瓶后打开止水夹,观察到B中的水倒吸入A中的圆底烧瓶,并在导管尖嘴处产生喷泉,仅根据A中的实验现象无法证明NaOH与CO2发生了反应,也可能是二氧化碳溶于水形成的喷泉,为了确保变量只有一个,所以加入相同体积的蒸馏水,即将注射器中的5mLNaOH溶液换为5mL的蒸馏水,通过对比产生喷泉的大小也可从与(1)相同的角度(反应物的消失)证明该反应发生;
甲组:A中反应后的溶质是什么?
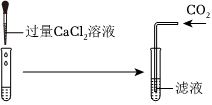
根据实验结论猜想2成立,即A中反应后的溶质为氢氧化钠和碳酸钠,取少量A中的溶液于试管中,加入过量的BaCl2(或CaCl2)溶液,检验并除去碳酸钠,氯化钡(或氯化钙)与碳酸钠反应生成碳酸钡沉淀(或碳酸钙沉淀)和氯化钠,观察到产生白色沉淀,说明含有碳酸钠,过滤,给滤液中加入酚酞溶液,酚酞为红色,说明含有氢氧化钠,即可说明猜想2成立;
乙组:C中盐酸是否过量?
根据结论猜想1成立,即C中盐酸过量,取少量C中的无色溶液于试管中,向其中加入Fe粉,铁与盐酸反应生成氯化亚铁和氢气,观察到黑色粉末消失,有气泡产生,溶液由无色变为浅绿色,即可说明盐酸过量,即猜想1成立;
[拓展与反思]
代替乙组实验方案中Fe粉,也能得出猜想1成立;
A、银不与盐酸反应,不能代替铁粉,不符合题意;
B、氧化铜与盐酸反应生成氯化铜和水,观察到黑色固体溶解,溶液由无色变为蓝色,说明盐酸过量,即可说明猜想1成立,符合题意;
C、硝酸银溶液虽然能与盐酸反应生成白色的氯化银沉淀,但是C中的氯化钠也会与硝酸银反应生成氯化银沉淀,所以无法确定盐酸的存在,不符合题意;
故答案为:
(1)反应物消失;HCl+NaOH=NaCl+H2O;
(2)5mL蒸馏水;BaCl2(或CaCl2);有气泡产生,溶液由无色变为浅绿色;B。
[点评]
本题考查了"实验探究物质的组成成分以及含量,碱的化学性质,盐的化学性质,",属于"难典题",熟悉题型是解题的关键。
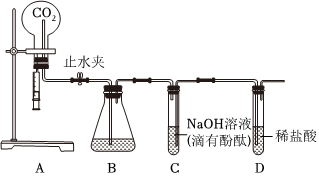 无明显现象实验的可视化研究是实验探究的重要内容。某兴趣小组同学在老师的指导下借助下列装置探究无明显现象的反应:
无明显现象实验的可视化研究是实验探究的重要内容。某兴趣小组同学在老师的指导下借助下列装置探究无明显现象的反应: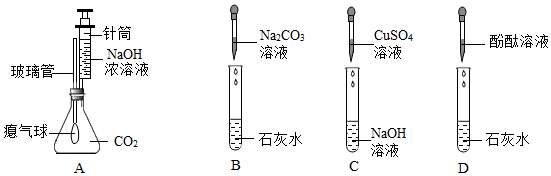
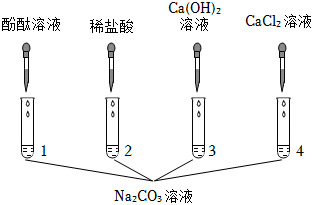 ?
?
 兴趣小组同学自制呼吸面具,准备用过氧化钠(Na2O2)作为供氧剂,但在实验室找到了一瓶敞口放置的过氧化钠。
兴趣小组同学自制呼吸面具,准备用过氧化钠(Na2O2)作为供氧剂,但在实验室找到了一瓶敞口放置的过氧化钠。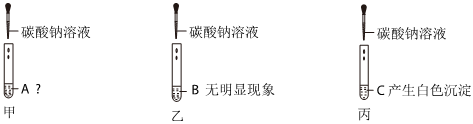
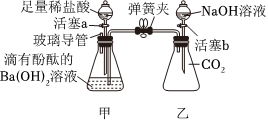
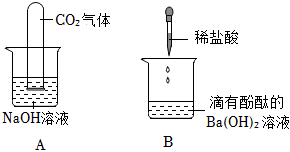 实验课上,某化学小组探究两个初中常见的无明显现象的反应:甲同学利用装置A将装满CO2的试管倒扣在盛有NaOH溶液的烧杯中,乙同学借助无色酚酞溶液利用装置B进行中和反应,如图所示:
实验课上,某化学小组探究两个初中常见的无明显现象的反应:甲同学利用装置A将装满CO2的试管倒扣在盛有NaOH溶液的烧杯中,乙同学借助无色酚酞溶液利用装置B进行中和反应,如图所示: