[解析]
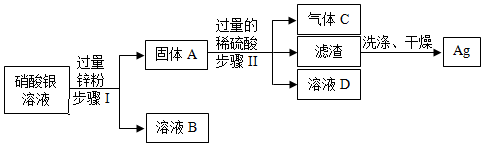
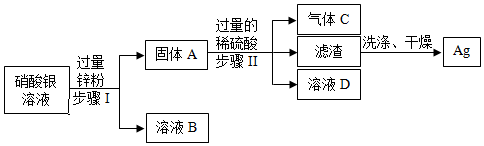
解:过量锌粉能与硝酸银溶液反应生成硝酸锌溶液和银,固体A为银和锌的混合物,溶液B为硝酸锌溶液,锌能与过量的稀硫酸反应生成硫酸锌溶液和氢气,铜不与稀硫酸反应,则气体C为氢气,溶液D为硫酸锌和硫酸的混合溶液。
(1)步骤由将固体与溶液分离的操作,实验操作名称是过滤,玻璃棒的作用是引流;
(2)步骤Ⅱ中,锌和稀硫酸反应生成硫酸锌和氢气,发生的化学反应方程式Zn+H2SO4=H2↑+ZnSO4
(3)由上述实验可得出锌、银、氢由强到弱的活动顺序为Zn>H>Ag;
(4)溶液D为硫酸锌和硫酸的混合溶液,若往溶液D中加入适量的锌、氧化锌、氢氧化锌、碳酸锌,都能得到一种溶液及硫酸锌,故选ABCD。
故答案为:
(1)引流; (2)Zn+H2SO4=H2↑+ZnSO4 ;(3)Zn>H>Ag.(4)A B C D。



 ?
?