[考点]
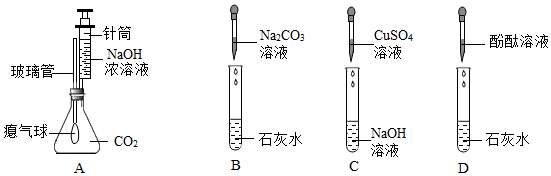
实验探究物质的组成成分以及含量,常见气体的检验与除杂方法,生石灰的性质与用途,
[答案]
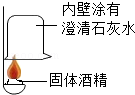
探究一:CaO+H2O=Ca(OH)2;
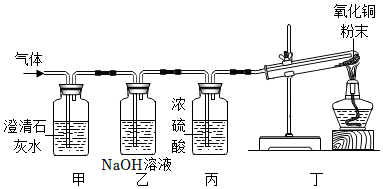
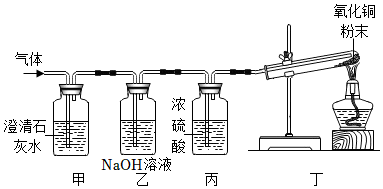
探究二:【假设猜想】根据质量守恒定律,反应前后元素的种类不变,反应物中没有氮元素,不可能生成氮气;
【观察现象】试管内黑色粉末逐渐变红;
【表达交流】(1)CO2+2NaOH=Na2CO3+H2O;
(2)干燥氢气,防止水蒸气对氢气的检验产生影响;
【拓展应用】(1)密封干燥;
(2)发热包中有铝粉,铝粉具有可燃性,由于铝粉在空气中遇明火会燃烧,可能诱发火灾。
[解析]
解:探究一:根据题干信息可知,发热包中含有氧化钙,氧化钙与水反应生成氢氧化钙,同时放出大量的热,反应的化学方程式为CaO+H2O=Ca(OH)2;
探究二:【假设猜想】根据质量守恒定律,反应前后元素的种类不变,反应物中没有氮元素,不可能生成氮气,则猜想四不正确;
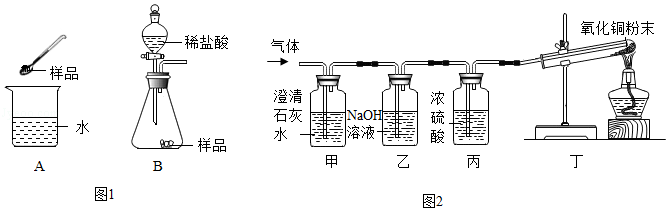
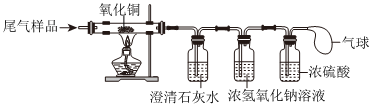
【观察现象】猜想三正确,则生成的气体是H2和CO2,丁装置中发生的反应是氢气和氧化铜在加热的条件下反应生成铜和水,则丁装置中观察到试管内黑色粉末逐渐变红,同时试管壁上有水珠产生;
【表达交流】(1)乙装置中是氢氧化钠和二氧化碳反应生成碳酸钠和水,反应的化学方程式为CO2+2NaOH=Na2CO3+H2O;
(2)丙装置中是浓硫酸,浓硫酸具有吸水性,且与氢气不反应,则丙装置的作用是干燥氢气,防止水蒸气对氢气的检验产生影响;
【拓展应用】(1)发热包中含有氧化钙,氧化钙能与水反应,且发热包中的铝容易与空气中的氧气反应,则自热米饭”的发热包应密封干燥保存;
(2)发热包中有铝粉,铝粉具有可燃性,由于铝粉在空气中遇明火会燃烧,可能诱发火灾,故发热包上的安全警示图标有“远离明火”。
故答案为:探究一:CaO+H2O=Ca(OH)2;
探究二:【假设猜想】根据质量守恒定律,反应前后元素的种类不变,反应物中没有氮元素,不可能生成氮气;
【观察现象】试管内黑色粉末逐渐变红;
【表达交流】(1)CO2+2NaOH=Na2CO3+H2O;
(2)干燥氢气,防止水蒸气对氢气的检验产生影响;
【拓展应用】(1)密封干燥;
(2)发热包中有铝粉,铝粉具有可燃性,由于铝粉在空气中遇明火会燃烧,可能诱发火灾。
[点评]
本题考查了"实验探究物质的组成成分以及含量,常见气体的检验与除杂方法,生石灰的性质与用途,",属于"典型题",熟悉题型是解题的关键。
 ?
? ?
?