[考点]
实验探究物质的组成成分以及含量,碱的化学性质,盐的化学性质,
[答案]
【作出猜想】Na2CO3;
【实验探究】Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
【解释与结论】(1)Na2CO3和Ca(OH)2;
(2)BaCl2、NaCl和NaOH;
【反思交流】不正确;
【迁移应用】bc.
[解析]
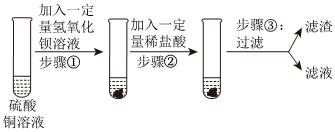
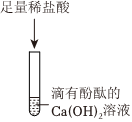
解:【作出猜想】氧化钙和水反应生成氢氧化钙,氢氧化钙易吸收空气中二氧化碳生成碳酸钙和水,二氧化碳和氢氧化钠反应生成碳酸钠和水,由于未说明变质的程度,上述过程的五种物质都可能含有,所以该碱石灰的主要成分可能含有CaO、Ca(OH)2、CaCO3、NaOH和Na2CO3;
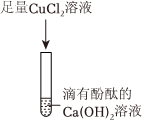
【实验探究】步骤一:将样品溶于水,其中氧化钙和水反应会放热,氢氧化钠溶于水时会放热,但题目中描述无明显的放热现象,说明样品中不含氧化钙和氢氧化钠。静置后有白色沉淀产生,该白色沉淀为碳酸钙,可能是原来样品中本来就含有的碳酸钙,也有可能是样品中的氢氧化钙和碳酸钠反应生成来的,所以晓聪同学认为此结论不准确,反应的化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
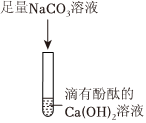
步骤二:依据碳酸钠溶液能和氯化钡溶液反应生成碳酸钡沉淀和氯化钠,取少量上层清液于另一试管中,向其中滴加过量BaCl2溶液,有白色沉淀生成,说明一定含有碳酸钠;过滤后所得物质能使酚酞试液变红,说明有氢氧化钠(此时溶液中不可能有氢氧化钙,因为碳酸钠有剩余),又因为原固体混合物中没有NaOH,所以应该是Ca(OH)2和Na2CO3反应生成了NaOH,因此固体混合物中一定有Ca(OH)2;
【解释与结论】(1)根据以上步骤一和步骤二探究分析可知:该碱石灰样品一定含有的物质是碳酸钠和氢氧化钙,化学式是:Na2CO3和Ca(OH)2;
(2)步骤二中加入了过量的氯化钡溶液,且与碳酸钠反应生成了氯化钠,而步骤一中碳酸钠和氢氧化钙反应又会生成碳酸钙沉淀和氢氧化钠,所以其上层清液中的溶质除酚酞外还一定含有三种溶质:氯化钠、氢氧化钠、氯化钡;
【反思交流】她的说法是不正确的,因为氯化钡溶液过量,所以上层清液中有氯化钡,加入适量的硫酸镁溶液后,二者可以反应生成硫酸钡沉淀和氯化镁,也会观察到白色沉淀产生,对氢氧化钠的检验造成干扰;
【迁移应用】碱石灰呈碱性,不能干燥酸性气体,上述所给气体中,一氧化碳是中性气体,不与酸碱反应;氯化氢、二氧化碳是酸性气体,要与碱性物质反应;氨气为碱性气体,要与 酸性物质反应,则可以用碱石灰干燥的是一氧化碳和氨气,故选:bc。
故答案为:
【作出猜想】Na2CO3;
【实验探究】Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
【解释与结论】(1)Na2CO3和Ca(OH)2;
(2)BaCl2、NaCl和NaOH;
【反思交流】不正确;
【迁移应用】bc.
[点评]
本题考查了"实验探究物质的组成成分以及含量,碱的化学性质,盐的化学性质,",属于"难典题",熟悉题型是解题的关键。
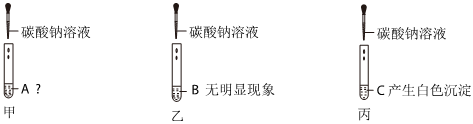
 ?
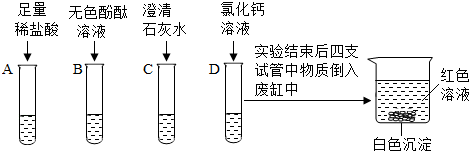
? 无明显现象实验的可视化研究是实验探究的重要内容。某兴趣小组同学在老师的指导下借助下列装置探究无明显现象的反应:
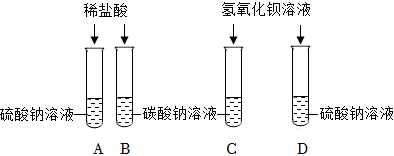
无明显现象实验的可视化研究是实验探究的重要内容。某兴趣小组同学在老师的指导下借助下列装置探究无明显现象的反应: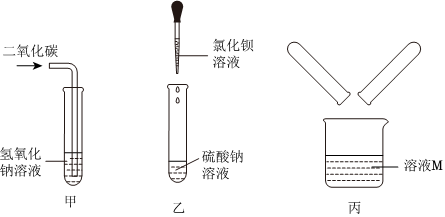
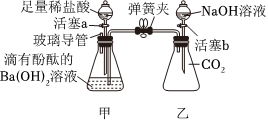
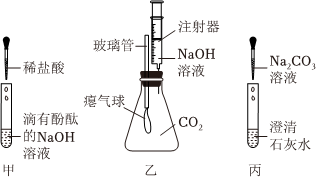
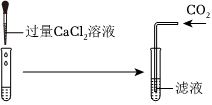 兴趣小组同学自制呼吸面具,准备用过氧化钠(Na2O2)作为供氧剂,但在实验室找到了一瓶敞口放置的过氧化钠。
兴趣小组同学自制呼吸面具,准备用过氧化钠(Na2O2)作为供氧剂,但在实验室找到了一瓶敞口放置的过氧化钠。